
【题目】
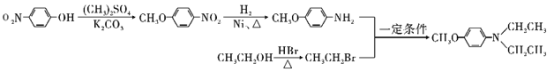
以芳香烃A为原料制备某重要医药中间体F的合成路线如下:
![]()
试回答下列问题:
(1)B的化学名称为___________。
(2)F中所含官能团的名称为___________。
(3)由A生成B和由D生成E的反应类型分别是___________、___________。
(4)已知G的分子式为C4H9Br2N,在一定条件下C与G反应生成 ,写出该反应的化学方程式___________。
,写出该反应的化学方程式___________。
(5)写出同时满足下列条件的D的两种同分异构体的结构简式___________、___________。
①含有苯环,且分子中含有4种不同化学环境的氢;
②既能与盐酸反应,又能发生银镜反应。
(6)请以![]() 、(CH3)2SO4、CH3CH2OH为原料,结合本题信息和流程图中的图例,写出制备
、(CH3)2SO4、CH3CH2OH为原料,结合本题信息和流程图中的图例,写出制备![]() 的合成路线流程图(其它无机试剂任选)。
的合成路线流程图(其它无机试剂任选)。
_______________________________________________________。
【答案】2 -硝基甲苯或邻硝基甲苯 酯基、肽健(或“酰胺键") 取代反应 氧化反应 
【解析】
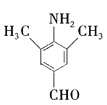
由A为芳香烃以及A转化B的反应条件,结合B的分子式,可判断A是![]() ,B是
,B是 ,结合B到C的条件可知C为
,结合B到C的条件可知C为![]() 。在观察
。在观察![]() 到
到![]() 的结构变化,结合G的分子式推测出G的结构筒式为BrCH2CH2NHCH2CH2Br。(6)根据题干E转化为F的信息,可将羟基转化为-OCH,根据题干B转化为C的信息,可将硝基转化为氨基,已知乙醇能和浓氢溴酸反应生成溴乙烷,再结合问题(4)中的新知识,合成
的结构变化,结合G的分子式推测出G的结构筒式为BrCH2CH2NHCH2CH2Br。(6)根据题干E转化为F的信息,可将羟基转化为-OCH,根据题干B转化为C的信息,可将硝基转化为氨基,已知乙醇能和浓氢溴酸反应生成溴乙烷,再结合问题(4)中的新知识,合成![]() 。
。
(1)结合上述分析知B的化学名称为2 -硝基甲苯或邻硝基甲苯;答案:2 -硝基甲苯或邻硝基甲苯。
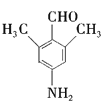
(2)由F的结构简式![]() 可知F中所含官能团的名称为酯基、肽健(或“酰胺键")。答案:酯基、肽健(或“酰胺键")
可知F中所含官能团的名称为酯基、肽健(或“酰胺键")。答案:酯基、肽健(或“酰胺键")
(3)A生成B的过程中硝基取代了苯环上的氢原子,属了取代反应;D生成E的甲基被氧化为羧基,属于氧化反应。答案:取代反应;氧化反应。
(4)现察![]() 到
到![]() 的结构变化,结合G的分子式推测出G的结构筒式为
的结构变化,结合G的分子式推测出G的结构筒式为
BrCH2CH2NHCH2CH2Br,据此写出化学方程式: ;答案:
;答案: 。
。
(5)根据D的同分异构体性质,可推侧出其含有的官能团氨基和醛基,说明另外两种化学环境的氢原子分别在甲基和苯坏上。因能与盐酸反应,故含有-NH2,又能发生银镜反应说明含有-CHO,据此写出
 ;答案:
;答案:
 。
。
(6)以![]() 、(CH3)2SO4、CH3CH2OH为原料,制备
、(CH3)2SO4、CH3CH2OH为原料,制备![]() 的合成路线流程图为:
的合成路线流程图为:
。答案: 。
。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸与高锰酸钾发生反应快速制备氯气。化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(1)用单线桥法表示该反应过程中的电子转移情况。________________,该反应中HCl被氧化和未被氧化的物质的量之比为________。
(2)下列装置为实验室制备氯气的装置。
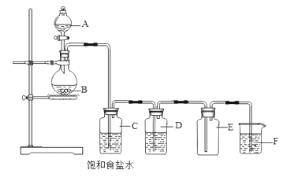
装置C的作用是______________________,装置E的作用是_______________________________。装置F中的试剂是_________________。
(3)写出F中发生的离子反应方程式________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是一种非金属,可以用作光敏材料、电解锰行业催化剂.
(l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为__.
(2)根据价层电子对互斥理论,可以推知SeO3的分子空间构型为__,其中Se原子采用的轨道杂化形式为__。
(3)CSe2与CO2结构相似,CSe2分子内σ键与π键个数之比为__,CSe2首次是由H2Se与CCl4反应后制取的,CSe2分子内的Se﹣C﹣Se键角__(填“大于”,“等于”或“小于”)H2Se分子内的H﹣Se﹣H键角。
(4)硒化铷晶体属于反萤石型结构,晶胞结构如图所示。每个晶胞中包含__个Rb2Se单元,其中Se2﹣周围与它距离最近且相等的Rb+的离子数目为__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.5molL-1的烧碱溶液480mL,根据溶液配制的过程,回答下列问题:
(1)实验中除了托盘天平(带砝码)、药匙、烧杯、量筒和玻璃棒外,还需要的其他玻璃仪器有:___和___。
(2)根据计算得知,所需NaOH固体的质量为___g。
(3)实验开始前,需要先___。
(4)配制溶液的过程中,有以下操作,其中正确的是___(填代号)。
A.将氢氧化钠固体放在纸片上称量;
B.在烧杯中溶解氢氧化钠固体后,立即将溶液倒入容量瓶中;
C.将溶解氢氧化钠的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中
(5)下列各项操作中,可能导致实际浓度偏高的是___(填选项字母)
A.称量NaOH固体时,砝码和物质的位置对调
B.向容量瓶中转移时,不慎洒出
C.NaOH溶解时放出大量的热,未及冷却立即配制溶液
D.定容时,仰视容量瓶的刻度线
E.定容时,加水超过刻度线,再用胶头滴管吸出多余的部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组欲探究Cl2与KI溶液的反应,设计实验装置如图。

已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大,其原因为I2(s)+I-(aq)![]() I3-(aq)
I3-(aq)
完成下列填空:
(1)仪器A使用前必须进行的操作是___________,仪器B的名称是___________。
(2)该实验设计装置存在明显缺陷是___________,改进之后,进行后续实验。
(3)C中的试剂是___________;当E装置中出现___________时,停止加热。
(4)当氯气开始进入D时,D中看到的现象是____________;不断向D中通入氯气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,试运用平衡移动原理分析产生这些现象的原因_____。
(5)持续不断地向D中通入氯气,看到D中液体逐渐澄清,最终呈无色。实验小组猜想,D中无色溶液里的含碘物质可能是HIO3。
①按照实验小组的猜想,用化学方程式解释“D中液体逐渐澄清,最终呈无色”的原因_____。
②为了验证猜想是否正确,实验小组又进行如下实验:
ⅰ.取反应后D中溶液5.00mL(均匀)于锥形瓶中,加入KI(过量)和足量稀硫酸。
ⅱ.向上述锥形瓶中滴加淀粉指示剂,溶液变蓝,用0.6250mol/L的Na2S2O3溶液滴定至蓝色刚好褪去,消耗Na2S2O3溶液VmL。
已知:2HIO3+10KI+5H2SO4=6I2+5K2SO4+6H2O、I2+2S2O32-=2I-+S2O62-,若V=___________时,说明实验小组的猜想正确。
(6)欲检验某溶液中是否含有I-,可使用的试剂为溴水和四氯化碳。合理的实验操作为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是

A. X电极连接电源负极
B. N为阳离子交换膜
C. Y电极反应式为 O2+2H2O+4e-=4OH-
D. 制备2.4g LiOH产生的H2在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.2kJ/mol
2NH3(g) ΔH=-92.2kJ/mol
(1)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_____________。
②按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
(2)L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

ⅰ X代表的物理量是______。
ⅱ 判断L1、L2的大小关系,并简述理由:______。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:

① 电极b上发生的是______反应(填“氧化”或“还原”)
② 写出电极a的电极反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S,已知甲池中发生的反应:


下列说法正确的是( )
A. 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ
B. 乙池溶液中发生的反应为H2S+I3-=3I-+S+2H+
C. 该装置中电能转化为光能
D. H+从甲池移向乙池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到目的是
A. 用PH试纸测定次氯酸溶液的pH
B. 将FeCl3溶液加热蒸干并灼烧获得Fe2O3固体
C. 向明矾溶液中加入一定量NaOH,制备Al(OH)3胶体
D. 室温下,测得pH=5的NaHSO4溶液与pH=9的NaHCO3溶液中水的电离程度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com