
【题目】硒是一种非金属,可以用作光敏材料、电解锰行业催化剂.
(l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为__.
(2)根据价层电子对互斥理论,可以推知SeO3的分子空间构型为__,其中Se原子采用的轨道杂化形式为__。
(3)CSe2与CO2结构相似,CSe2分子内σ键与π键个数之比为__,CSe2首次是由H2Se与CCl4反应后制取的,CSe2分子内的Se﹣C﹣Se键角__(填“大于”,“等于”或“小于”)H2Se分子内的H﹣Se﹣H键角。
(4)硒化铷晶体属于反萤石型结构,晶胞结构如图所示。每个晶胞中包含__个Rb2Se单元,其中Se2﹣周围与它距离最近且相等的Rb+的离子数目为__。

【答案】(8分)(1)1s22s22p63s23p63d104s24p4(2分)
(2)平面三角形;sp2(2分)
(3)1:1;大于(2分)
(4)4;8(2分)
【解析】
试题(l)硒是34号元素,基态原子核外有34个电子,所以根据构造原理可知,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p4。
(2)根据价层电子对互斥理论可知,SeO3的分子中中心原子含有的孤对电子对数=(6-3×2)÷2=0。这说明分子中含有3个价层电子对,且没有孤电子对,所以其空间构型是平面三角形,采用sp2杂化。
(3)二氧化碳分子中含有2个碳氧双键,单键都是σ键,双键是由1个σ键与1个π键构成的,所以CO2分子内σ键与π键个数之比为2:2=1:1。CSe2与CO2结构相似,所以CSe2分子内σ键与π键个数之比也是1:1。二氧化碳是直线型分子,H2Se分子与水分子的空间构型相似,剩余v型分子,所以CSe2分子内的Se-C-Se键角大于H2Se分子内的H-Se-H键角。
(4)根据晶胞的结构可知,白色球都在晶胞内部,所以该晶胞中含有白色球个数=8,黑色球个数=8×![]() +6×
+6×![]() =4,所以每个晶胞中包含4个Rb2Se单元。由于1个面被8个面共用,根据晶胞结构可知,最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8个。
=4,所以每个晶胞中包含4个Rb2Se单元。由于1个面被8个面共用,根据晶胞结构可知,最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8个。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的盐酸,丙为未知浓度的FeCl2溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________。
(3)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需________(填写仪器名称)。
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是_______。
③某同学设计的下列滴定方式中,最合理的是________(夹持部分略去,填字母序号),达到滴定终点的现象是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Li和石墨的复合材料以及纳米Fe2O3材料作电极的锂离子电池,在循环充放电过程中可实现对磁性的可逆调控(如图)。下列有关说法一定错误的是
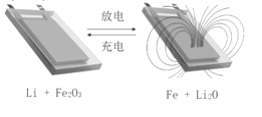
A. 该电池的电解质溶液可以是硫酸溶液
B. 放电时,总反应式是6Li+Fe2O3=3Li2O+2Fe
C. 充电时,阳极的电极反应是2Fe+3Li2O-6e-= Fe2O3+6Li+
D. 充放电过程中,电池可在被磁铁不吸引和吸引之间循环调控
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山道年蒿中提取出一种具有明显抗癌活性的有机物X,其结构简式如下图所示。下列有关说法错误的是

A. 该物质的分子式为C10H16O2
B. 该物质不可能所有的碳原子共平面
C. 该物质的一氯代物共有7种
D. 该物质能发生加成、取代、氧化、消去、还原等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 3d3表示3d能级上有3个轨道
B. ns能级的原子轨道图都可以用如图表示
C. 1s电子云呈球形,表示电子绕原子核做圆周运动
D. 电子云图的黑点密度越大,说明核外空间电子数越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构):


(1)C60、金刚石和石墨三者的关系是互为________。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于___(填“离子”、“原子”或“分子”)晶体,C60分子中含有双键的数目是___。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是______NA个。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Ba2+、CO32-、Cl-、SO42-。现取两份200mL溶液分别进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,以下推测正确的是( )
A.一定存在NH4+、CO32-、SO42-,一定不存在Ba2+、Cl-
B.一定存在NH4+、CO32-、Cl-、SO42-,可能存在K+
C.c(SO42-)=0.2mol/L,c(NH4+)>c(SO42-)
D.若溶液中存在K+、NH4+、CO32-、Cl-、SO42-五种离子,则c(K+)>0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
以芳香烃A为原料制备某重要医药中间体F的合成路线如下:
![]()
试回答下列问题:
(1)B的化学名称为___________。
(2)F中所含官能团的名称为___________。
(3)由A生成B和由D生成E的反应类型分别是___________、___________。
(4)已知G的分子式为C4H9Br2N,在一定条件下C与G反应生成 ,写出该反应的化学方程式___________。
,写出该反应的化学方程式___________。
(5)写出同时满足下列条件的D的两种同分异构体的结构简式___________、___________。
①含有苯环,且分子中含有4种不同化学环境的氢;
②既能与盐酸反应,又能发生银镜反应。
(6)请以![]() 、(CH3)2SO4、CH3CH2OH为原料,结合本题信息和流程图中的图例,写出制备
、(CH3)2SO4、CH3CH2OH为原料,结合本题信息和流程图中的图例,写出制备![]() 的合成路线流程图(其它无机试剂任选)。
的合成路线流程图(其它无机试剂任选)。
_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:

已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl ![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(菱锰矿粉)分别为____________、____________、____________。

(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围__,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应(还原产物是Cr3+)的离子方程式为___________。
②试样中锰的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com