
现有下列七种物质:
①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦HCl
(1)上述物质中属于电解质的有 。(填序号)
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是 。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-=H2O,则该反应的化学方程式为 。
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
(9分)生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 极,b极的电极反应式为 。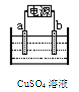
(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为 ,X的化学式为 ,该反应的氧化剂和还原剂的物质的量之比为 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式 。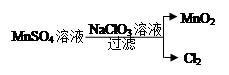
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知在含HNO3的溶液中放入Al不生成H2;某无色溶液里,只含有下列11种离子中的几种:Mg2+、Fe3+、H+、Ag+、Ba2+、SO42-、HCO3-、OH-、MnO4-、NO3-、CO32-。已知该溶液能跟金属铝反应,且放出的气体只有氢气。试回答:
(1)若溶液跟铝反应只有AlO2-生成,则原溶液一定含有的大量的物质是________(填化学式),发生反应的离子方程式是_____________________________________________________,还可能含有的较多的物质是__________________(填化学式)。
(2)若溶液跟铝反应后有Al3+生成,则原溶液中可能(包括一定能)大量存在的离子是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行如下实验:
(1)取少量固体粉末加到足量水中,得到白色沉淀,上层为无色清液。
(2)继续往其中加入足量稀硝酸,白色沉淀完全消失,并有气泡产生。
(3)取少量⑵中的溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
根据上述实验现象判断:该白色固体中一定含有__________________,一定不含有________,可能含有_____________。
如何验证可能存在的物质
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液仅含下列离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1 mol 。
阳离子:Na+ 、Mg2+ 、Fe3+ 、Al3+ 、Fe2+ ;阴离子:OH—、CO32—、Cl—、NO3—、SO42—。
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,溶液中阴离子种类不变; 请推断:
(1)原溶液中含有阳离子 含有阴离子
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体
质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图所示是中学化学里常见纯净物A—L间的反应关系,其中A、H、E、F为单质且E、F为气体,B在常温下是无色液体,C是淡黄色固体,L是红褐色固体。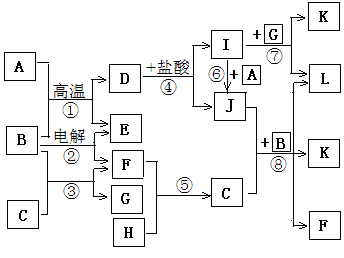
请根据图示判断并回答下列问题:
(1)单质A中所含元素在周期表中的位置是 ;
(2)反应③的化学方程式为 ;
(3)反应④的离子方程式为 ;
(4)反应⑧的离子方程式为 ;
(5)反应②发生过程中,当有3.01×1024个电子发生转移时,电解消耗物质B的质量为 g,同时阴极生成的气体的体积为 L(换算为标准状况下的体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D四种溶液,它们是烧碱、硫酸、碳酸氢铵、氯化铜溶液中的某一种。各取少量,将其两两混合,其中A、B混合有蓝色絮状沉淀生成, C 与足量B或D混合均有无色气体产生。根据题意回答下列问题:
(1)B、C分别是 、
(2)向A中滴加B,离子方程式:
向C中滴加D,离子方程式:
(3)少量B和C混合,现象:________,离子方程式:_______________________________。
(4)上述三个反应均属于________________反应(填基本反应类型),反应发生的条件的不同点是 ;相同点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)现有以下物质:①NaCl晶体 ②SO2 ③稀硫酸 ④石墨 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精 ⑧熔融的KNO3 ⑨CaO ⑩纯净的醋酸
请回答下列问题(用序号):
以上物质中能导电的是 ;以上物质中属于电解质的是 。
(2)按要求写出下列对应的方程式:
(①电离方程式、②化学方程式、③离子方程式)
①Al2(SO4)3:
②CO2+2OH-=CO32-+H2O:
③NaHCO3与NaHSO4溶液反应:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。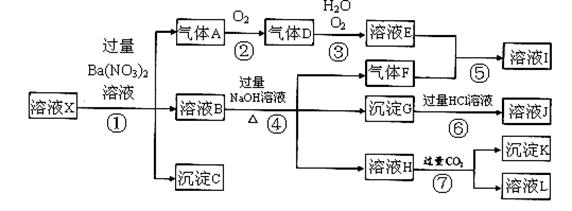
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 :
(2)溶液X中,关于NO3ˉ的判断一定正确的是 ;
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为 ;
(4)转化⑥发生反应的现象为 ;
(5)转化④中产生H的离子方程式为 ;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比
为 ;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是 。
①NaOH溶液, ②KSCN溶液, ③石蕊试剂, ④pH试纸,⑤KMnO4溶液,
⑥氯水和KSCN的混合溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com