
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算错误的是
A.有CO、CO2、O3三种气体,它们各含有2 mol O,则三种气体物质的量之比为6:3:2
B.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为35.5m/n
C.常温下,a L氧气和氮气的混合物含有的分子数就是![]() ×6.02×1023个
×6.02×1023个
D.2.8 g CO在标准状况下的体积为2.24L
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】I.下列对晶体结构和性质的认识错误的是______
A.“雪花→水→水蒸气→氧气和氢气”变化中,被破坏的粒子间的作用力依次是:氢键、氢键、极性键
B.晶体CO2和H2O中,微利间相互作用完全相同,晶体类型也相同
C.SiO2晶体最小的环上,有6个Si原子和6个O原子
D.金刚石和石墨的熔点都较高,是因为二者都为原子晶体
II.黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:2CuFeS2+O2=Cu2S+2FeS+SO2。
(1)Fe在周期表中的位置为______________________;Fe、S、O原子的第一电离能由大到小的顺序是_________________________。
(2)CuFeS2中Cu元素有________个未成对电子,Cu2S中Cu元素基态时电子排布式为__________。
(3)SO2分子的立体构型为_____________,SO2可氧化生成SO3,SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是__________________。

(4)已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS 的原因_________。

(5)Cu的晶胞如图所示,晶体密度为ρ g·cm-3。晶胞中等距最近的Cu原子有_____个,晶胞的边长为___________(用含ρ和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
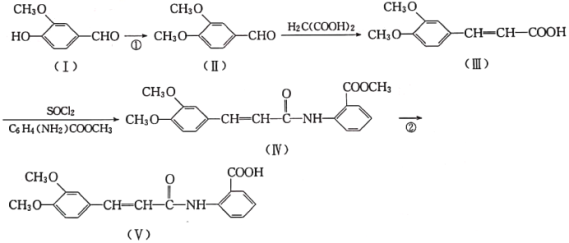
【题目】以香兰醛(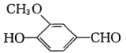 )为主要原料合成药物利喘贝(V)的流程如下:
)为主要原料合成药物利喘贝(V)的流程如下:
已知:![]() (酰胺键)在无肽键酶作用下的水解可忽略。
(酰胺键)在无肽键酶作用下的水解可忽略。
(1)H2C(COOH)2的化学名称为___________。
(2)①的反应类型是___________。
(3)反应②所需试剂条件分别为___________、___________。
(4)利喘贝(V)的分子式为___________。
(5)Ⅲ中官能团的名称是______________________。
(6)写出与香兰醛互为同分异构体的酯类化合物的结构简式(且核磁共振氢谱为四组峰,峰面积之比为1:2:2:3):____________________________________________(写出3种)。
(7)已知:![]() ,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(
,结合上述流程中的信息,设计以甲苯和甲醇为起始原料制备邻氨基苯甲酸甲酯(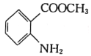 )的合成路线(其他无机试剂任选):__________________________________________________________________。
)的合成路线(其他无机试剂任选):__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是

A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为10-4.74 mol·L-1
C. 当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
C. 在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆
D. 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g)![]() CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
A. 单位时间内消耗2 mol的CO同时生成2 mol的CO2
B. 两个H—O键断裂的同时有一个H—H键断裂
C. 反应容器内的压强不再发生变化
D. 混合气体的相对分子质量不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:

回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取H2.下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) △H1=+571.6kJmol﹣1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJmol﹣1
③甲烷与水反应制氢:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
A. 反应CH4(g)= C(s)+2 H2(g)的△H=+74.8kJmol﹣1 。
B. 电解水也可制取氢气和氧气,而且比方法①更方便,更节能。
C. 反应②每生成2g氢气,要吸收131.3kJ的热量,所以该反应没有应用价值。
D. 反应③中,若将各1mol的甲烷与水蒸气混合,要吸收206.1kJ的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的相对位置如下图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )

A. Z元素的氧化物对应的水化物一定是一种强酸
B. 在三种元素形成的气态氢化物中,Y的气态氢化物最稳定
C. 三种元素原子半径的大小顺序为:X>Y>Z
D. Z的单质与 Fe 反应生成的化合物中,铁元素显+3价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com