
����Ŀ�����ͭ����ȼ�ϵ�أ���ͼ�������ߡ��ɱ��ͣ��õ��ͨ��һ�ָ��ӵ�ͭ��ʴ���������������������зŵ����Ϊ��2Li��Cu2O��H2O��2Cu��2Li+��2OH-������˵���������
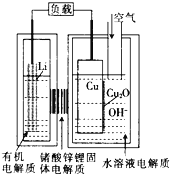
A.�ŵ�ʱ������·��ͨ��0.2mol���ӵĵ���ʱ����0.2mol Li+������������Cu���ƶ����б�״����1.12L�������뷴Ӧ
B.ͨ����ʱ��ͭ����ʴ���������Cu2O
C.�ŵ�ʱ�������ĵ缫��ӦʽΪ��Cu2O��H2O��2e-��2Cu��2OH-
D.������Ӧ���̣������е�O2���˴���������
���𰸡�D
��������
�ŵ�ʱ���ʧ������������Cu��O2�õ����������������ϵ缫��ӦʽΪLi-e-�TLi+�������ϵ缫��ӦʽΪO2+4e-+2H2O=4OH-���������Һ���������������ƶ������������ƶ����ݴ˷������
A���ŵ�ʱ����������������������ƶ������������ƶ�������·��ͨ��0.2 mol���ӵĵ���ʱ������4Cu+O2===2Cu2O��O2+4e-+2H2O=4OH-�������ϲ��뷴Ӧ������Ϊ0.05mol���ڱ�״���µ����Ϊ0.05mol��22 .4L/mol=1.12L����A��ȷ��
B���õ��ͨ��һ�ָ��ӵ�ͭ��ʴ�������������ɷ���ʽ��֪ͭ�缫�ϲ���������ֱ�ӷŵ磬������ӦΪCu2O+H2O+2e-=Cu+2OH-�����ͨ�������Ŀ������������ͭ��Ӧ����Cu2O����B��ȷ��
C���õ��ͨ��һ�ָ��ӵ�ͭ��ʴ�������������ɷ���ʽ��֪ͭ�缫�ϲ���������ֱ�ӷŵ磬������ӦΪCu2O+H2O+2e-=Cu+2OH-����C��ȷ��
D��ͨ����ʱ��ͭ����ʴ���������Cu2O���ŵ�ʱCu2Oת��ΪCu����������Ӧ�����У�ͭ�൱�ڴ�����������ΪO2����D����
�ʴ�ΪD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ԭ��Ӧ�����������ͻ�ԭ��Ϊͬһ�����ʵ���
A.MgO+2HCl=MgCl2+H2OB.C+H2O(g)![]() CO+H2
CO+H2
C.8NH3+6NO2![]() 7N2+12H2OD.2Na2O2+2H2O=4NaOH+O2��
7N2+12H2OD.2Na2O2+2H2O=4NaOH+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������X������Y ��0.16 mol����10 L �����ܱ������У�������Ӧ��X��g��+ Y��g��![]() 2Z��g�� ��H < 0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±�������˵����ȷ����
2Z��g�� ��H < 0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±�������˵����ȷ����
t / min | 2 | 4 | 7 | 9 |
n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.��Ӧǰ2min��ƽ������v��Z��=2.0��10-5 mol/��L��min��
B.�����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv���棩��v������
C.���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D.�����������䣬�ٳ���0.2 mol Z��ƽ��ʱX�����ʵ���Ũ�ȼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ������˵����ȷ����
A.�����£�23g NO2��N2O4�Ļ�����庬��NA����ԭ��
B.1L0.1molL-1�İ�ˮ����0.1NA��OH�D
C.��״���£�NO��O2��11.2L��ϣ����û������ķ�������Ϊ0.75NA
D.1molFe��1molCl2��ַ�Ӧ��ת��3NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4����һ�����͡���Ч�������ɫˮ����������Cl2��O2��ClO2��KMnO4�����Ը�ǿ��������Ⱦ����ҵ�������Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����ͣ�ʹ�������������
(1)�ɷ��Ʊ��������Ƶ���Ҫ��ӦΪ��2FeSO4 + aNa2O2��2Na2FeO4 + bX + 2Na2SO4 +cO2���÷�Ӧ������XӦ��__________��b��c�Ĺ�ϵ��_______________��
(2)ʪ���Ʊ�������ط�Ӧ��ϵ��������������Fe(OH)3��ClO����OH����FeO42-��Cl����H2O��
��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��__________________��
��ÿ����1mol FeO42-ת��_____________mol���ӣ�����Ӧ������ת����0.3mol���ӣ���ԭ��[������ʵ���Ϊ_____________mol��
����֪��2Fe3����2I��=2Fe2����I2��2Fe2����Br2=2Fe3����2Br����
(3)����1 mol FeI2��2 mol FeBr2����Һ��ͨ��2 mol Cl2����ʱ�����������Ӽ������ʵ�����_______________________________��
(4)����a mol FeI2��b mol FeBr2����Һ��ͨ��c mol Cl2����I����Fe2����Br����ȫ������ʱ��cΪ________________________________(�ú�a��b�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaNO2����һ������Ʒ�����г�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ��������������Ư�ס���Ƶȷ���Ӧ��Ҳ�ܹ㷺��ij��ȤС�����������ͼ��ʾ��װ���Ʊ�NaNO2��A�м���װ������ȥ����
��֪�������£���2NO+Na2O2===2NaNO2
�����������£�NO ��NO2-������MnO4-��Ӧ����NO3-��Mn2+
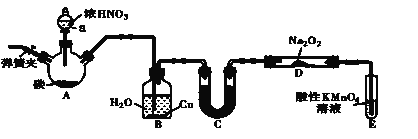
��1��A�з�����Ӧ�Ļ�ѧ����ʽΪ_________________________________��
��2��������װ�õ������ԣ�װ��ҩƷ��ʵ�鿪ʼǰͨ��һ��ʱ��N2��Ȼ��رյ��ɼУ��ٵμ�Ũ���ᣬ���ȡ�ͨ��N 2��������______________��
��3��װ��B�й۲쵽����Ҫ����Ϊ_________________
��4����Ϊ��֤�Ƶõ��������ƵĴ��ȣ�Cװ����ʢ�ŵ��Լ�������___________������ĸ��ţ���
A��P2O5 B����ˮCaCl2 C����ʯ�� D��Ũ����
�����ȡ��Cװ�ã�D�й�������NaNO2�⣬���ܺ��еĸ�������________ д��ѧʽ����
��5��E�з�����Ӧ�����ӷ���ʽΪ____________��
��6����1.56g Na2O2��ȫת��ΪNaNO2��������������Ҫľ̿__________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵���������
A.��״���£�������Ȼ�ϵ�������һ����̼���干8.96L�������������г��ȼ��ʱ���������ķ�����Ϊ0.2NA
B.�ö��Ե缫�������ͭ��Һʱ������Һ��pHֵ��Ϊ1ʱ����缫��ת�Ƶĵ�����ĿΪNA
C.32.5 gп��һ����Ũ����ǡ����ȫ��Ӧ����������ķ�����Ϊ0.5NA
D.��Ӧ3H2(g)��N2(g)![]() 2NH3(g)����H����92 kJ��mol��1�����ų�����9.2 kJʱת�Ƶ���0.6NA
2NH3(g)����H����92 kJ��mol��1�����ų�����9.2 kJʱת�Ƶ���0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ�̬��������������У����¹����H2O��CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵������ȷ���ǣ� ��
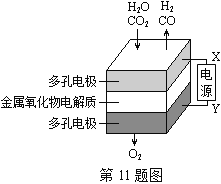
A. X�ǵ�Դ�ĸ���
B. �����ķ�Ӧʽ�ǣ�H2O��2e����H2��O2��CO2��2e����CO��O2��
C. �ܷ�Ӧ�ɱ�ʾΪ��H2O��CO2H2��CO��O2
D. �������������ɵ���������ʵ���֮����1�U1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A. CCl4����CH4�Ƶã�����ȡ��ˮ�еĵ�
B. ��ϩ�ͼױ�����������ԭ�Ӷ���ͬһ��ƽ����
C. ú�Ϳ���ʯ�ͷ����ã�������ȼ�Ϻͱ�������������
D. ![]() ��CH3-CH=CH2��Ϊͬ���칹��
��CH3-CH=CH2��Ϊͬ���칹��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com