
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,23g NO2和N2O4的混合气体含有NA个氧原子
B.1L0.1molL-1的氨水含有0.1NA个OH―
C.标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA
D.1molFe与1molCl2充分反应,转移3NA个电子
【答案】A
【解析】
A.NO2和N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量为n=![]() =0.5mol,含有1mol氧原子,即NA个,故A正确;
=0.5mol,含有1mol氧原子,即NA个,故A正确;
B.NH3H2O为弱碱,在溶液中不能完全电离,故溶液中的氢氧根的个数小于0.1NA个,故B错误;
C.标况下,一氧化氮和氧气反应生成二氧化氮,二氧化氮能自身转化为四氧化二氮,2NO2 ![]() N2O4,导致混合气体的分子总数小于0.75NA,故C错误;
N2O4,导致混合气体的分子总数小于0.75NA,故C错误;
D.1molFe与1molCl2充分反应时,2Fe + 3Cl2 ![]() 2FeCl3,铁过量,1mol氯气完全反应,由于氯元素由0价变为-1价,故1mol氯气转移2mol电子,即2NA个,故D错误;
2FeCl3,铁过量,1mol氯气完全反应,由于氯元素由0价变为-1价,故1mol氯气转移2mol电子,即2NA个,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】用如图所示装置研究原电池原理。下列叙述错误的是
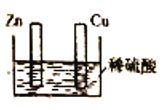
A.Cu棒和Zn棒用导线连接时,铜片上有气泡逸出
B.Cu棒和Zn棒不连接时,锌片上有气泡逸出
C.无论Cu棒和Zn棒是否用导线连接,装置中所涉及的总反应都相同
D.无论Cu棒和Zn棒是否用导线连接,装置都是把化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH ="-92.4" kJmol-1,下列关于该反应的说法正确的是
2NH3(g)ΔH ="-92.4" kJmol-1,下列关于该反应的说法正确的是
A. 反应达到平衡时共放出46.2 kJ的热量
B. 若将容器体积压缩至0.5L,可提高单位体积内活化分子百分数,从而加快正反应速率,降低逆反应速率
C. 任何时刻均有:υ(N2)=3υ(H2)=2υ(NH3)
D. 若保持容器体积不变,继续通入0.5mol N2和1.5mol H2,则N2的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g) ![]() 2Z(g),有关下列图像说法正确的是
2Z(g),有关下列图像说法正确的是
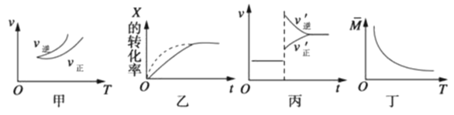
A.依据图甲可判断正反应为吸热反应
B.在图乙中,虚线可表示压强增大
C.若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近的研究发现,复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,因而受到许多发达国家的青睐。MnFe2O4的制备流程如下:

(1)原料Fe(NO3)n中n=______,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为______。
(2)步骤二中“连续搅拌”的目的是______;步骤三中洗涤干净的标准是______。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:MnFe2O4![]() MnFe2O4﹣x+
MnFe2O4﹣x+![]() O2↑、MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑。请认真分析上述两个反应并回答下列问题:
O2↑、MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑。请认真分析上述两个反应并回答下列问题:
①若MnFe2O4﹣x中x=0.6,则MnFe2O4﹣x中Fe2+占全部铁元素的百分率为______。
②该热化学循环制氢法的优点有______(答两点即可)。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。 水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是_________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
则步骤Ⅰ中加入Na2CO3可除去水垢中的______________________。
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有____________________________。
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因__________________。
(4)步骤Ⅲ中,加入Na2SO3的目的是______________________。(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①完成并配平其反应的离子方程式:
____Fe+____NO2-+____H2O=______N2↑+__________+_______。
②如果有16.8 g铁被钝化,则转移的电子数为___________________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是
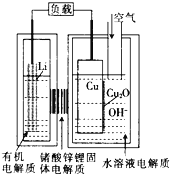
A.放电时,当电路中通过0.2mol电子的电量时,有0.2mol Li+透过固体电解质向Cu极移动,有标准状况下1.12L氧气参与反应
B.通空气时,铜被腐蚀,表面产生Cu2O
C.放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
D.整个反应过程,空气中的O2起了催化剂的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“摇头丸”是毒品中的一种,其中含有国家监管的药品——氯胺酮,它有致幻作用,在一定条件下发生一系列转化:
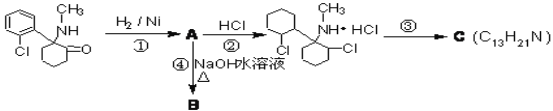
(1)氯胺酮中含氧官能团名称为__________,上述转化过程中发生加成反应的是_____(填序号)
(2)反应③的条件__________,C的结构有两种,其中一种结构只含有一个手性碳原子(连接四个不同原子或原子团的碳原子叫手性碳原子),其结构简式为__________
(3)步骤④的化学反应方程式_____________________________________________
(4)有一种去甲基氯胺酮D,能发生如下反应:(已知:琥珀醛酸的分子式为C4H6O3)

①由E→F的转化过程中,氰基硼氢化钠所体现的性质为_____________________
②H的分子式为_______________________
③M的分子式为C10H10O3 ,符合下列条件的同分异构体有___________种
i与琥珀醛酸具有相同官能团 ii含苯环且苯环上有两个取代基
④N是与琥珀醛酸具有相同官能团一种同分异构体,以N为主要原料合成 ___________
___________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。
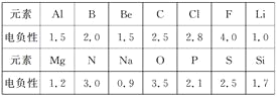
①判断下列化合物中属于离子化合物的是________(填字母);
A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC
②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为__________________________;NCl3水解产物为____________________。
(2)观察Li、Be、Mg、Al在元素周期表中的位置回答:
![]()
①铍的最高价氧化物的水化物是________(填“酸性”、“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是_____________________________________________________;
②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为__________(用化学式表示)。
(3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)
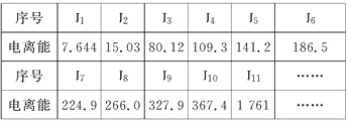
①外层电子离核越远,能量越高,电离能越__________(填“大”或“小”);阳离子电荷数越高,失去电子时,电离能越________(填“大”或“小”);
②上述11个电子分属________个电子层;
③失去了11个电子后,该元素还有________个电子;
④该元素最高价氧化物对应水化物的化学式是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com