
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应:X(g)+ Y(g)![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的物质的量浓度减小
【答案】C
【解析】
A、2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,故v(Y)= =0.002mol/(L·min),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(L·min)=0.004mol/(L·min),故A错误;
=0.002mol/(L·min),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(L·min)=0.004mol/(L·min),故A错误;
B、该反应正反应是放热反应,降低温度平衡向正反应移动,反应达到新平衡前v(逆)<v(正),故B错误;
C、由表中数据可知7min时,反应到达平衡,平衡时Y的物质的量为0.10mol,则:

由于反应前后气体的化学计量数相等,用物质的量代替浓度进行计算,故化学平衡常数k=![]() =1.44,故C正确;
=1.44,故C正确;
D、再通入0.2 mol Z,等效为在原平衡基础上增大压强,反应前后气体的体积不变,平衡不移动,X的体积分数不变,故D错误;
故选:C。


科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
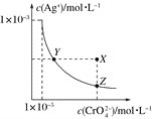
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置(如图)。

已知:
①溶液呈酸性且阴离子为SO42-;
②溶液中颜色:V3+绿色,V2+紫色,VO2+黄色,VO2+蓝色;
③放电过程中,右槽溶液的颜色由紫色变成绿色。
下列说法不正确的是
A.放电时B极为负极
B.放电时若转移的电子数为3.01×1023个,则左槽中H+增加0.5 mol
C.充电过程中左槽的电极反应式为:VO2++H2O-e- =VO2++2H+
D.充电过程中H+通过质子交换膜向右槽移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L容器中充入0.5mol N2和1.5mol H2发生反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH ="-92.4" kJmol-1,下列关于该反应的说法正确的是
2NH3(g)ΔH ="-92.4" kJmol-1,下列关于该反应的说法正确的是
A. 反应达到平衡时共放出46.2 kJ的热量
B. 若将容器体积压缩至0.5L,可提高单位体积内活化分子百分数,从而加快正反应速率,降低逆反应速率
C. 任何时刻均有:υ(N2)=3υ(H2)=2υ(NH3)
D. 若保持容器体积不变,继续通入0.5mol N2和1.5mol H2,则N2的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2是重要的耐高温材料,可用作陶瓷遮光剂。天然锆英石的主要成分为ZrSiO4,另外还含有铁、铝、铜等金属元素的氧化物杂质,工业上以天然锆英石为原料制备ZrO2的工艺流程如下图所示:
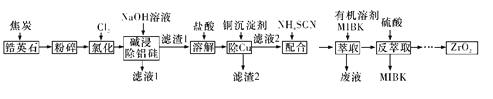
已知:Fe(SCN)3难溶于MIBK; Zr(SCN)4在水中的溶解度不大,易溶于MIBK。
请回答下列问题:
(1)ZrSiO4锆元素的化合价为____________。
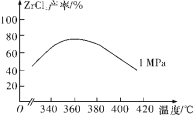
(2)“氯化”主反应为ZrSiO4(s)+2C(s)+4Cl2(g)![]() ZrCl4(g)+SiCl4(g)+2CO2(g) ΔH<0,相同时间内ZrCl4的产率随温度变化如图所示,由图可知“氯化”的最佳温度是________________。“氯化”过程中ZrCl4的产率随温度升高先增大后减小的原因是_________。
ZrCl4(g)+SiCl4(g)+2CO2(g) ΔH<0,相同时间内ZrCl4的产率随温度变化如图所示,由图可知“氯化”的最佳温度是________________。“氯化”过程中ZrCl4的产率随温度升高先增大后减小的原因是_________。
(3)写出Al2O3高温“氯化”过程中转化为AlCl3的化学方程式: ____________。
(4)本流程使用NaCN除铜,若盐酸“溶解”后溶液中的c(Cu2+)=0.01 mol·L-1,当溶液中Cu2+开始沉淀时,c(CN-)=______________。{已知Ksp[Cu(CN)2]=4.00×10-10}
(5)实验室进行“萃取”和“反萃取”的玻璃仪器是________。流程中“萃取”与“反萃取”的目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g) ![]() 2Z(g),有关下列图像说法正确的是
2Z(g),有关下列图像说法正确的是
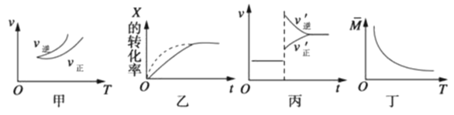
A.依据图甲可判断正反应为吸热反应
B.在图乙中,虚线可表示压强增大
C.若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近的研究发现,复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,因而受到许多发达国家的青睐。MnFe2O4的制备流程如下:

(1)原料Fe(NO3)n中n=______,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为______。
(2)步骤二中“连续搅拌”的目的是______;步骤三中洗涤干净的标准是______。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:MnFe2O4![]() MnFe2O4﹣x+
MnFe2O4﹣x+![]() O2↑、MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑。请认真分析上述两个反应并回答下列问题:
O2↑、MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑。请认真分析上述两个反应并回答下列问题:
①若MnFe2O4﹣x中x=0.6,则MnFe2O4﹣x中Fe2+占全部铁元素的百分率为______。
②该热化学循环制氢法的优点有______(答两点即可)。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是
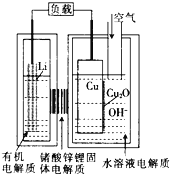
A.放电时,当电路中通过0.2mol电子的电量时,有0.2mol Li+透过固体电解质向Cu极移动,有标准状况下1.12L氧气参与反应
B.通空气时,铜被腐蚀,表面产生Cu2O
C.放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
D.整个反应过程,空气中的O2起了催化剂的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1
N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
①a、b、c三点逆反应速率由大到小的顺序为_______。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)![]() 2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为___________交换膜,正极上的电极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com