
【题目】ZrO2是重要的耐高温材料,可用作陶瓷遮光剂。天然锆英石的主要成分为ZrSiO4,另外还含有铁、铝、铜等金属元素的氧化物杂质,工业上以天然锆英石为原料制备ZrO2的工艺流程如下图所示:
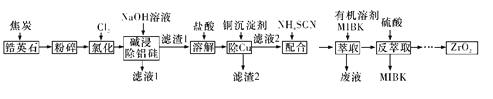
已知:Fe(SCN)3难溶于MIBK; Zr(SCN)4在水中的溶解度不大,易溶于MIBK。
请回答下列问题:
(1)ZrSiO4锆元素的化合价为____________。
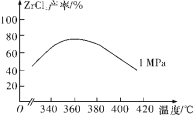
(2)“氯化”主反应为ZrSiO4(s)+2C(s)+4Cl2(g)![]() ZrCl4(g)+SiCl4(g)+2CO2(g) ΔH<0,相同时间内ZrCl4的产率随温度变化如图所示,由图可知“氯化”的最佳温度是________________。“氯化”过程中ZrCl4的产率随温度升高先增大后减小的原因是_________。
ZrCl4(g)+SiCl4(g)+2CO2(g) ΔH<0,相同时间内ZrCl4的产率随温度变化如图所示,由图可知“氯化”的最佳温度是________________。“氯化”过程中ZrCl4的产率随温度升高先增大后减小的原因是_________。
(3)写出Al2O3高温“氯化”过程中转化为AlCl3的化学方程式: ____________。
(4)本流程使用NaCN除铜,若盐酸“溶解”后溶液中的c(Cu2+)=0.01 mol·L-1,当溶液中Cu2+开始沉淀时,c(CN-)=______________。{已知Ksp[Cu(CN)2]=4.00×10-10}
(5)实验室进行“萃取”和“反萃取”的玻璃仪器是________。流程中“萃取”与“反萃取”的目的是_______。
【答案】+4 360 ℃ 360 ℃以前反应未达到平衡,升温过程中反应继续向正向进行,产率不断增大;360 ℃以后反应达到平衡,由于该反应为放热反应,升温过程中平衡逆向移动,ZrCl4产率又减小 2Al2O3+3C+6Cl2![]() 4AlCl3+3CO2 2×10-4 mol/L 分液漏斗、烧杯 除去铁元素杂质
4AlCl3+3CO2 2×10-4 mol/L 分液漏斗、烧杯 除去铁元素杂质
【解析】
根据流程:天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质与焦炭、氯气高温氯化,主要的反应为ZrSiO4+2C+4Cl2![]() ZrCl4+SiCl4+2CO2,2Al2O3+3C+6Cl2
ZrCl4+SiCl4+2CO2,2Al2O3+3C+6Cl2![]() 4AlCl3+3CO2,同理铁、铜的氧化物,将得到ZrCl4、SiCl4、AlCl3、FeCl3、CuCl2用NaOH溶液碱浸,SiCl4、AlCl3溶解为硅酸钠、偏铝酸钠,ZrCl4、FeCl3、CuCl2反应为Zr(OH)4、Fe(OH)3、Cu(OH)2沉淀,即为滤渣1,用盐酸将滤渣1溶解,得到ZrCl4、FeCl3、CuCl2,使用NaCN除铜,滤渣2为Cu(CN)2,向滤液加入NH4SCN与ZrCl4、FeCl3发生配合反应得到Fe(SCN)3、Zr(SCN)4,加入 有机溶剂MIBK萃取,Fe(SCN)3难溶于MIBK,分液,Zr(SCN)4在有机层,将含有Zr(SCN)4的有机层用硫酸反萃取将Zr(SCN)4与MIBK分离,经过一系列操作得到ZrO2,据此分析作答。
4AlCl3+3CO2,同理铁、铜的氧化物,将得到ZrCl4、SiCl4、AlCl3、FeCl3、CuCl2用NaOH溶液碱浸,SiCl4、AlCl3溶解为硅酸钠、偏铝酸钠,ZrCl4、FeCl3、CuCl2反应为Zr(OH)4、Fe(OH)3、Cu(OH)2沉淀,即为滤渣1,用盐酸将滤渣1溶解,得到ZrCl4、FeCl3、CuCl2,使用NaCN除铜,滤渣2为Cu(CN)2,向滤液加入NH4SCN与ZrCl4、FeCl3发生配合反应得到Fe(SCN)3、Zr(SCN)4,加入 有机溶剂MIBK萃取,Fe(SCN)3难溶于MIBK,分液,Zr(SCN)4在有机层,将含有Zr(SCN)4的有机层用硫酸反萃取将Zr(SCN)4与MIBK分离,经过一系列操作得到ZrO2,据此分析作答。
(1)由于在化合物中元素正负化合价代数和等于0,O为-2价,Si为+4价,可得锆英石(ZrSiO4)中Zr元素的化合价为+4价。
(2)根据图象可知ZrCl4的产率在温度为360 ℃时最高,说明“氯化”的最佳温度是360 ℃;根据图象可知,在360 ℃以前,随着温度的升高,ZrCl4的产率逐渐增大,是由于温度升高,反应物分子的能量增加,有效碰撞次数增加,反应速率加快,更多的反应物发生反应变为生成物,所以ZrCl4的产率逐渐增大,到360℃达到最大值,此时反应达到平衡状态,由于该反应的正反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使ZrCl4的产率逐渐降低,因此温度升高,ZrCl4的产率又逐渐降低。
(3)Al2O3、焦炭在高温下与氯气反应产生AlCl3、CO2,根据电子守恒、原子守恒可得该反应方程式为2Al2O3+3C+6Cl2![]() 4AlCl3+3CO2;
4AlCl3+3CO2;
(4)由于Ksp[Cu(CN)2]=c(Cu2+)·c2(CN-)=4.00×10-10,c(Cu2+)=0.01 mol/L,当溶液中Cu2+开始沉淀时,c(CN-)=![]() =2.00×10-4 mol/L。
=2.00×10-4 mol/L。
(5)由于萃取是分离互不相溶的液体混合物的方法,所以萃取和反萃取使用的仪器有分液漏斗和烧杯;在处理过程中Cu2+与沉淀试剂形成Cu(CN)2沉淀过滤除去,Fe3+与加入的NH4SCN形成络合物Fe(SCN)3,Zr4+形成Zr(SCN)4,由于Fe(SCN)3难溶于MIBK,而Zr(SCN)4在水中溶解度不大,易溶于MIBK,向Fe(SCN)3、Zr(SCN)4的混合溶液中加入MIBK充分振荡后,分液,可将Fe(SCN)3分离除去,然后向MIBK的溶液中加入硫酸进行反萃取,Zr(SCN)4进入硫酸溶液中,然后经过一系列处理,就可得到ZrO2。所以进行萃取和反萃取目的是除去铁元素杂质。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了一系列实验,根据具体实验回答下列问题:
Ⅰ.制取![]()
化学反应方程式为![]() 。
。
(1)根据实验需要,下列![]() 装置中___________(填序号)最适合制备
装置中___________(填序号)最适合制备![]() 。
。

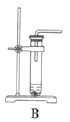
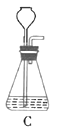

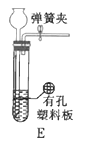
(2)在实验中发现,![]() 气体产生缓慢,但又不存在气密性问题,分析可能的原因:____________、_________________。(任写两条)
气体产生缓慢,但又不存在气密性问题,分析可能的原因:____________、_________________。(任写两条)
Ⅱ.制取![]() 、
、![]() 混合气体并验证(实验装置如图所示)
混合气体并验证(实验装置如图所示)
化学反应方程式为![]() 。
。

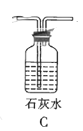
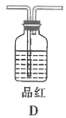
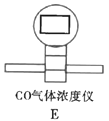
(3)根据实验需要,请从下列![]() 装置中选择最适合的装置并将其序号填在下面的空格中:Ⅰ、Ⅱ处连接的装置分别是________________、________________。上图中装水的洗气瓶的作用是___________。
装置中选择最适合的装置并将其序号填在下面的空格中:Ⅰ、Ⅱ处连接的装置分别是________________、________________。上图中装水的洗气瓶的作用是___________。

Ⅲ.测定样品中![]() 的含量
的含量
(4)某草酸亚铁样品中含有少量硫酸亚铁,设计用滴定法测定该样品中![]() 的含量,滴定反应为
的含量,滴定反应为![]() 。
。
实验方案设计如下:
①将准确称量的ag草酸亚铁样品置于![]() 锥形瓶内,加入适量
锥形瓶内,加入适量![]() 的
的![]() 溶解,加热至70℃左右,立即用浓度为
溶解,加热至70℃左右,立即用浓度为![]() 的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液
的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液![]() 。
。
②向上述滴定混合液中加入适量的![]() 粉和过量的
粉和过量的![]() 的
的![]() 溶液,煮沸(不含
溶液,煮沸(不含![]() ),继续用
),继续用![]() 的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液
的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液![]() 。回答下列问题:
。回答下列问题:
步骤②中检验溶液不含![]() 的操作为取1滴煮沸后的溶液滴入装有___________________溶液的试管中,若_______,则说明溶液不含
的操作为取1滴煮沸后的溶液滴入装有___________________溶液的试管中,若_______,则说明溶液不含![]() 。计算
。计算![]() (
(![]() 的摩尔质量为
的摩尔质量为![]() )的质量分数为__________%。(用含
)的质量分数为__________%。(用含![]() 的式子表示)
的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
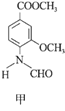
【题目】合成一种用于合成 γ 分泌调节剂的药物中间体,其合成的关键一步如图:
![]()
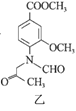
下列有关化合物甲、乙的说法正确的是
A.甲→乙的反应为加成反应
B.甲分子中至少有8个碳原子在同一平面上
C.甲、乙均不能使溴水褪色
D.乙与足量 H2 完全加成的产物分子中含有4个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。下列说法不正确的是
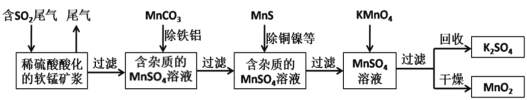
A.上述流程中多次涉及到过滤操作,实验室进行过滤操作时需用到的硅酸盐材质仪器有:玻璃棒、烧杯、漏斗
B.用MnCO3能除去溶液中的Al3+和Fe3+,其原因是MnCO3消耗了溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀
C.实验室用一定量的NaOH溶液和酚酞试液就可以准确测定燃煤尾气中的SO2含量
D.MnSO4溶液→MnO2过程中,应控制溶液pH不能太小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g) ![]() 2Z(g) ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )
2Z(g) ΔH<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是( )
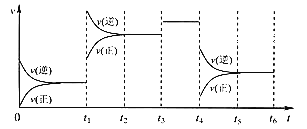
A. t1时升高了温度 B. t3时加入了催化剂
C. t4时降低了压强 D. 在t3~t4时间内,X的体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应:X(g)+ Y(g)![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的物质的量浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为10L的密闭容器中,进行如下反应:A(g)+2B(g)![]() C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图1.
C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图1.

试回答下列问题:
(1)800℃时,0~5min内,以B表示的平均反应速率为 .
(2)能判断反应达到化学平衡状态的依据是 (填字母).
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0mol A和2.2mol B,利用图中数据计算800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”).
(4)700℃时,某时刻测得体系中物质的量浓度如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).
(5)在催化剂作用下,CO可用于合成甲醇:CO(g)+2H2(g)CH3OH(g)若在恒温恒压的条件下,向密闭容器中充入4mol CO和8mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示:

①该反应的正反应属于__________反应;(填“吸热”或“放热”).
②在0.1Mpa、100℃的条件下,该反应达到平衡时容器内气体的物质的量为 mol。
若在恒温恒容的条件下,向上述平衡体系中充入4mol CO,8mol H2,与原平衡状态相比,达到平衡时CO转化率 (填“增大”,“不变”或“减小”),平衡常数K (填“增大”,“不变”或“减小”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + aNa2O2=2Na2FeO4 + bX + 2Na2SO4 +cO2↑该反应中物质X应是__________,b与c的关系是_______________。
(2)湿法制备高铁酸钾反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:__________________。
②每生成1mol FeO42-转移_____________mol电子,若反应过程中转移了0.3mol电子,则还原产[物的物质的量为_____________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(3)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子及其物质的量是_______________________________。
(4)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为________________________________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2]。下列有关说法正确的是( )
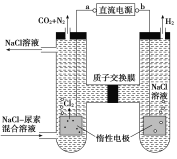
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 除去尿素的反应为:CO(NH2)2+2Cl2+H2O== N2+CO2+4HCl
D. 若两极共收集到气体0.6mol,则除去的尿素为0.12mol(忽略气体溶解,假设氯气全部参与反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com