
【题目】合成一种用于合成 γ 分泌调节剂的药物中间体,其合成的关键一步如图:
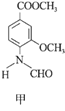
![]()
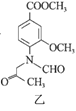
下列有关化合物甲、乙的说法正确的是
A.甲→乙的反应为加成反应
B.甲分子中至少有8个碳原子在同一平面上
C.甲、乙均不能使溴水褪色
D.乙与足量 H2 完全加成的产物分子中含有4个手性碳原子
科目:高中化学 来源: 题型:
【题目】铋酸钠是一种化学物质,浅黄色或褐色的无定形粉末,不溶于水,常用于锰离子的检验,其有一种制备流程如图:
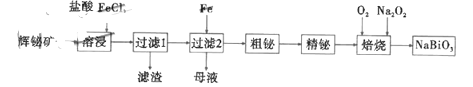
已知:a.辉铋矿(主要成分是![]() ,还含少量
,还含少量![]() 等杂质);
等杂质);
b.水解能力:![]() 。
。
回答下列问题:
(1)制备流程中,溶浸时加入过量的浓盐酸的作用是__________________________。
(2)溶浸时,为了提高浸取速率,可以采取的措施是_____________(填序号)。
a.加入足量的蒸馏水
b.搅拌
c.粉碎矿石
d.升髙温度
(3)过滤2所得“母液”中经过通入气体![]() 后可再循环利用,气体
后可再循环利用,气体![]() 最好是__________(填化学式)。
最好是__________(填化学式)。
(4)写出焙烧时生成铋酸钠的化学方程式:__________________________________,当消耗标准状况下![]() 时,转移电子的数目是________________。
时,转移电子的数目是________________。
(5)铋酸钠(![]() )可用于锰离子(
)可用于锰离子(![]() )的检验,如将铋酸钠固体加入到足量稀硫酸和硫酸锰
)的检验,如将铋酸钠固体加入到足量稀硫酸和硫酸锰![]() 的混合溶液中并加热,可得紫色溶液(
的混合溶液中并加热,可得紫色溶液(![]() 无色),此反应的离子方程式为_________。
无色),此反应的离子方程式为_________。
(6)25℃时,向浓度均为![]() 的
的![]() 、
、![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液(设溶液体积变化不计),当
溶液(设溶液体积变化不计),当![]() 开始沉淀时,所得悬浊液中
开始沉淀时,所得悬浊液中![]() _________。[已知:
_________。[已知:![]()
![]() 、
、![]() 、
、![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
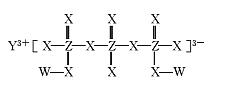
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1 mol丙酮酸![]() 在镍催化剂作用下加1 mol氢气转化变成乳酸。乳酸的结构简式为_________________________________________。
在镍催化剂作用下加1 mol氢气转化变成乳酸。乳酸的结构简式为_________________________________________。
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式是_________________________________
(3)B的甲酯可以聚合,聚合物的结构简式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A.澄清透明的溶液中:Na+、Cu2+、NO3-、Cl-
B.中性溶液中:Fe3+、NH4+、Br-、HCO3-
C.c(OH-)<![]() 的溶液中:Na+、Ca2+、ClO-、F-
的溶液中:Na+、Ca2+、ClO-、F-
D.1 mol/L的KNO3溶液中:H+、Fe2+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置(如图)。

已知:
①溶液呈酸性且阴离子为SO42-;
②溶液中颜色:V3+绿色,V2+紫色,VO2+黄色,VO2+蓝色;
③放电过程中,右槽溶液的颜色由紫色变成绿色。
下列说法不正确的是
A.放电时B极为负极
B.放电时若转移的电子数为3.01×1023个,则左槽中H+增加0.5 mol
C.充电过程中左槽的电极反应式为:VO2++H2O-e- =VO2++2H+
D.充电过程中H+通过质子交换膜向右槽移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域具有广泛应用。下图是利用乙酰丙酸(![]() )合成聚芳酯E的路线:
)合成聚芳酯E的路线:

已知:①![]()
②![]() (R、R′表示烃基)
(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团是羰基和_______(填官能团名称)。
(2)D的结构简式为_______。
(3)下列关于有机物B的说法正确的是_________(填字母代号)。
a.能发生取代反应 b.能与浓溴水反应
c.能发生消去反应 d.能与H2发生加成反应
(4)A→B的化学方程式为_________。
(5)C的分子式为_________,符合下列条件的C的同分异构体有_________种。
①能发生银镜反应
②能与NaHCO3溶液反应
③分子中有苯环,分子中无![]() 结构
结构
在上述同分异构体中,有一种苯环上有两个取代基且核磁共振氢谱图有4种峰的物质,写出该物质与足量NaOH溶液共热反应的化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2是重要的耐高温材料,可用作陶瓷遮光剂。天然锆英石的主要成分为ZrSiO4,另外还含有铁、铝、铜等金属元素的氧化物杂质,工业上以天然锆英石为原料制备ZrO2的工艺流程如下图所示:
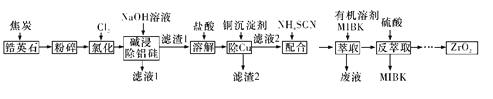
已知:Fe(SCN)3难溶于MIBK; Zr(SCN)4在水中的溶解度不大,易溶于MIBK。
请回答下列问题:
(1)ZrSiO4锆元素的化合价为____________。
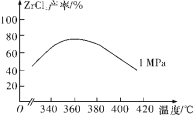
(2)“氯化”主反应为ZrSiO4(s)+2C(s)+4Cl2(g)![]() ZrCl4(g)+SiCl4(g)+2CO2(g) ΔH<0,相同时间内ZrCl4的产率随温度变化如图所示,由图可知“氯化”的最佳温度是________________。“氯化”过程中ZrCl4的产率随温度升高先增大后减小的原因是_________。
ZrCl4(g)+SiCl4(g)+2CO2(g) ΔH<0,相同时间内ZrCl4的产率随温度变化如图所示,由图可知“氯化”的最佳温度是________________。“氯化”过程中ZrCl4的产率随温度升高先增大后减小的原因是_________。
(3)写出Al2O3高温“氯化”过程中转化为AlCl3的化学方程式: ____________。
(4)本流程使用NaCN除铜,若盐酸“溶解”后溶液中的c(Cu2+)=0.01 mol·L-1,当溶液中Cu2+开始沉淀时,c(CN-)=______________。{已知Ksp[Cu(CN)2]=4.00×10-10}
(5)实验室进行“萃取”和“反萃取”的玻璃仪器是________。流程中“萃取”与“反萃取”的目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是____,每生成l mol Na2FeO4转移__mol电子。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO﹣、OH﹣、FeO42﹣、Cl﹣、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为______mol。
(3)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com