
【题目】铋酸钠是一种化学物质,浅黄色或褐色的无定形粉末,不溶于水,常用于锰离子的检验,其有一种制备流程如图:
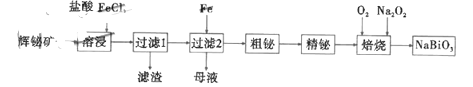
已知:a.辉铋矿(主要成分是![]() ,还含少量
,还含少量![]() 等杂质);
等杂质);
b.水解能力:![]() 。
。
回答下列问题:
(1)制备流程中,溶浸时加入过量的浓盐酸的作用是__________________________。
(2)溶浸时,为了提高浸取速率,可以采取的措施是_____________(填序号)。
a.加入足量的蒸馏水
b.搅拌
c.粉碎矿石
d.升髙温度
(3)过滤2所得“母液”中经过通入气体![]() 后可再循环利用,气体
后可再循环利用,气体![]() 最好是__________(填化学式)。
最好是__________(填化学式)。
(4)写出焙烧时生成铋酸钠的化学方程式:__________________________________,当消耗标准状况下![]() 时,转移电子的数目是________________。
时,转移电子的数目是________________。
(5)铋酸钠(![]() )可用于锰离子(
)可用于锰离子(![]() )的检验,如将铋酸钠固体加入到足量稀硫酸和硫酸锰
)的检验,如将铋酸钠固体加入到足量稀硫酸和硫酸锰![]() 的混合溶液中并加热,可得紫色溶液(
的混合溶液中并加热,可得紫色溶液(![]() 无色),此反应的离子方程式为_________。
无色),此反应的离子方程式为_________。
(6)25℃时,向浓度均为![]() 的
的![]() 、
、![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液(设溶液体积变化不计),当
溶液(设溶液体积变化不计),当![]() 开始沉淀时,所得悬浊液中
开始沉淀时,所得悬浊液中![]() _________。[已知:
_________。[已知:![]()
![]() 、
、![]() 、
、![]() ]
]
【答案】溶解矿物质;防止![]() 水解 bcd Cl2
水解 bcd Cl2 ![]()
![]()
![]()
![]()
【解析】
先将辉铋矿用酸溶解,在该过程中注意金属离子的水解,在该过程中,二氧化硅不溶解,以沉淀形式除去,后加铁置换出粗铋,溶液中的亚铁离子被氧化为三价即能循环使用,粗铋精炼后,再与氧气、过氧化钠在一定温度下得到铋酸钠。
(1)制备流程中,酸可以溶解铁矿物,溶解的金属离子会水解产生氢离子,故加浓酸可以抑制金属离子的水解;
(2)提高反应速率,可以增大反应物的浓度,该处是固体物质,故可以粉碎矿物,增大接触面积,升高温度也能提高反应速率;
故答案为:bcd;
(3)过滤2所得“母液”中通入气体![]() 后可再循环利用,发生反应:2FeCl2+Cl2=2FeCl3;
后可再循环利用,发生反应:2FeCl2+Cl2=2FeCl3;
故答案为:Cl2;
(4)焙烧时加入了氧气与过氧化钠,反应物还有粗铋,反应后生成铋酸钠,根据电子得失守恒,得出化学方程式为:![]() ;消耗标准状况下
;消耗标准状况下![]() 时,即消耗氧气的物质的量为:
时,即消耗氧气的物质的量为:![]() ,根据方程式可得,氧气与转移电子的关系式为:
,根据方程式可得,氧气与转移电子的关系式为:![]() ,则转移电子的数目为:
,则转移电子的数目为:![]() ;
;
(5)将铋酸钠固体加入到足量稀硫酸和硫酸锰![]() 的混合溶液中并加热,可得紫色溶液(
的混合溶液中并加热,可得紫色溶液(![]() 无色),则有高锰酸根生成,根据配平原则(得失电子守恒)可得此反应的离子方程式为:
无色),则有高锰酸根生成,根据配平原则(得失电子守恒)可得此反应的离子方程式为:![]() ;
;
(6)25℃时,向浓度均为![]() 的
的![]() 、
、![]() 、
、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液(设溶液体积变化不计),已知:
溶液(设溶液体积变化不计),已知: ![]() 、
、![]() ,硫化铁、硫化铅均是AB型沉淀,故悬浊液中
,硫化铁、硫化铅均是AB型沉淀,故悬浊液中![]() 之比即二者的沉淀平衡常数之比,
之比即二者的沉淀平衡常数之比,![]() 。
。


科目:高中化学 来源: 题型:
【题目】有机物X(C4H6O5)广泛存在于许多水果内,尤以葡萄、西瓜、山渣内为多,X的碳链结构无支链,分子式为C4H6O5;1.34gX与足量的钠溶液反应,生成标准状况下的气体0.336L。X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物。X在一定条件下可发生如下转化:X![]() A
A![]() B
B![]() C(X、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是( )
C(X、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是( )
A. X的结构简式为HOOC—CHOH—CH2—COOH
B. A的分子式为C4H4O4
C. 与M的官能团种类、数量完全相同的同分异构体还有3种
D. C物质能溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置可用来监测空气中NO的含量,下列说法正确的是( )
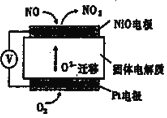
A.电子由Pt电极流出,经外电路流向NiO电极
B.Pt电极上发生的是氧化反应
C.NiO电极的电极反应式为NO+O2--2e-=NO2
D.每流经1 m3空气(假设NO被完全吸收),转移电子的物质的量为2×10-7mol,则该空气中NO的含量约为3×10-2mg/m3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是
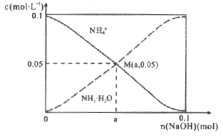
A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇制备1,2-二溴乙烷的反应原理如下:①乙醇在浓硫酸的存在下制取乙烯、②乙烯与溴反应制得1,2-二溴乙烷。可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:

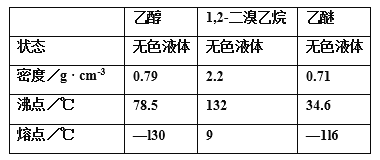
回答下列问题:
(1)写出乙醇在浓硫酸的存在下制取乙烯的化学方程式______________;浓硫酸所起的作用是___________ 。
(2)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_______;(填正确选项前的字母)
a.引发反应 b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(3)反应一段时间后三颈烧瓶A中的液体混合物会逐渐变黑,此时会发生另一个副反应生成其他酸性杂质气体,该反应的化学方程式为_________ 。
(4)在装置C中应加入______,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(5)判断该制备反应已经结束的最简单方法是________________;
(6)若产物中有少量副产物乙醚,可用_____________的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是________________;但又不能过度冷却(如用冰水),其原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、技术、社会发展息息相关。下列说法不正确的是( )
A.食醋除水垢、油脂的皂化、煤的干馏都是化学变化
B.侯氏制碱法的工艺过程中应用了物质溶解度的差异
C.黑火药是我国古代的四大发明之一,配方为“一硫二硝三木炭”,其中的硝指的是硝酸
D.“绿水青山就是金山银山”,矿物燃料经过脱硫脱硝处理,可减少![]() 、
、![]() 的排放
的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用Pt电极电解1 L浓度均为0.1 mol·L-1的HCl、CuSO4的混合溶液,装置如图,下列说法正确的是( )

A.电解开始时阴极有H2放出
B.电解开始时阳极上发生:Cu2++2e-Cu
C.整个电解过程中,SO42-不参与电极反应
D.当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了一系列实验,根据具体实验回答下列问题:
Ⅰ.制取![]()
化学反应方程式为![]() 。
。
(1)根据实验需要,下列![]() 装置中___________(填序号)最适合制备
装置中___________(填序号)最适合制备![]() 。
。

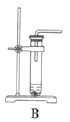
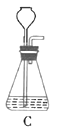

(2)在实验中发现,![]() 气体产生缓慢,但又不存在气密性问题,分析可能的原因:____________、_________________。(任写两条)
气体产生缓慢,但又不存在气密性问题,分析可能的原因:____________、_________________。(任写两条)
Ⅱ.制取![]() 、
、![]() 混合气体并验证(实验装置如图所示)
混合气体并验证(实验装置如图所示)
化学反应方程式为![]() 。
。

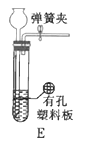
(3)根据实验需要,请从下列![]() 装置中选择最适合的装置并将其序号填在下面的空格中:Ⅰ、Ⅱ处连接的装置分别是________________、________________。上图中装水的洗气瓶的作用是___________。
装置中选择最适合的装置并将其序号填在下面的空格中:Ⅰ、Ⅱ处连接的装置分别是________________、________________。上图中装水的洗气瓶的作用是___________。

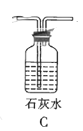
Ⅲ.测定样品中![]() 的含量
的含量
(4)某草酸亚铁样品中含有少量硫酸亚铁,设计用滴定法测定该样品中![]() 的含量,滴定反应为
的含量,滴定反应为![]() 。
。
实验方案设计如下:
①将准确称量的ag草酸亚铁样品置于![]() 锥形瓶内,加入适量
锥形瓶内,加入适量![]() 的
的![]() 溶解,加热至70℃左右,立即用浓度为
溶解,加热至70℃左右,立即用浓度为![]() 的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液
的高锰酸钾标准溶液滴定至终点,重复2~3次,平均消耗高锰酸钾溶液![]() 。
。
②向上述滴定混合液中加入适量的![]() 粉和过量的
粉和过量的![]() 的
的![]() 溶液,煮沸(不含
溶液,煮沸(不含![]() ),继续用
),继续用![]() 的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液
的高锰酸钾标准溶液滴定至终点,平均消耗高锰酸钾溶液![]() 。回答下列问题:
。回答下列问题:
步骤②中检验溶液不含![]() 的操作为取1滴煮沸后的溶液滴入装有___________________溶液的试管中,若_______,则说明溶液不含
的操作为取1滴煮沸后的溶液滴入装有___________________溶液的试管中,若_______,则说明溶液不含![]() 。计算
。计算![]() (
(![]() 的摩尔质量为
的摩尔质量为![]() )的质量分数为__________%。(用含
)的质量分数为__________%。(用含![]() 的式子表示)
的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成一种用于合成 γ 分泌调节剂的药物中间体,其合成的关键一步如图:
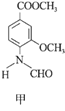
![]()
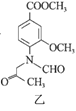
下列有关化合物甲、乙的说法正确的是
A.甲→乙的反应为加成反应
B.甲分子中至少有8个碳原子在同一平面上
C.甲、乙均不能使溴水褪色
D.乙与足量 H2 完全加成的产物分子中含有4个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com