
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + aNa2O2=2Na2FeO4 + bX + 2Na2SO4 +cO2↑该反应中物质X应是__________,b与c的关系是_______________。
(2)湿法制备高铁酸钾反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:__________________。
②每生成1mol FeO42-转移_____________mol电子,若反应过程中转移了0.3mol电子,则还原产[物的物质的量为_____________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(3)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子及其物质的量是_______________________________。
(4)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为________________________________(用含a、b的代数式表示)。
【答案】Na2O b=2c 3ClO-+2Fe(OH)3+4OH-=2FeO42-+3Cl-+5H2O 3 0.15 n(I-)=2mol,n(Fe2+)=2mol c=![]()
【解析】
Ⅰ.(1)反应中铁元素由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降守恒规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O,配平后方程式为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,可知b=2c,故答案为:Na2O;b=2c;
(2)①高铁酸钾是生成物,则Fe(OH)3是反应物,该反应中Fe元素化合价由+3价变为+6价,则Fe(OH)3是还原剂,还需要氧化剂参加反应,ClO-具有强氧化性,所以ClO-是反应物,生成物是Cl-,Cl元素化合价由+1价变为-1价,转移电子数为6,溶液在碱性条件下进行,则氢氧化根离子参加反应,生成水,反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O中Fe元素化合价由+3价升高到+6价,则该反应中转移电子数为6,每生成1molFeO42-转移电子物质的量=![]() =3mol,该反应中还原产物是氯离子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量=
=3mol,该反应中还原产物是氯离子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量=![]() =0.15mol,故答案为:3;0.15;
=0.15mol,故答案为:3;0.15;
Ⅱ.由2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Br-+2Fe3+可知,还原性强弱顺序是:I->Fe2+>Br-。
(1)向含有1molFeI2和2molFeBr2的溶液中通入2molCl2,先发生反应2I-+Cl2=I2+2Cl-,2mol碘离子完全反应需要氯气1mol,然后发生反应Cl2+2Fe 2+=2Cl-+2Fe3+,1mol氯气反应需要亚铁离子的物质的量是2mol,溶液中含有3mol亚铁离子,参加反应的亚铁离子的物质的量是2mol,所以溶液中还剩余亚铁离子1mol,所以被氧化的离子是2molI-、2molFe 2+,故答案为:n(I-)=2mol、n(Fe2+)=2mol;
(2)若向含amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Fe2+、Br-完全被氧化时,Fe2+失去的电子的物质的量为(a+b)mol,I-失去的电子的物质的量为2amol,Br-失去的电子的物质的量为2bmol,则共失去3(a+b)mol电子,所以需要氯气的物质的量:c=![]() mol,故答案为:c=
mol,故答案为:c=![]() 。
。


科目:高中化学 来源: 题型:
【题目】(1)1 mol丙酮酸![]() 在镍催化剂作用下加1 mol氢气转化变成乳酸。乳酸的结构简式为_________________________________________。
在镍催化剂作用下加1 mol氢气转化变成乳酸。乳酸的结构简式为_________________________________________。
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式是_________________________________
(3)B的甲酯可以聚合,聚合物的结构简式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2是重要的耐高温材料,可用作陶瓷遮光剂。天然锆英石的主要成分为ZrSiO4,另外还含有铁、铝、铜等金属元素的氧化物杂质,工业上以天然锆英石为原料制备ZrO2的工艺流程如下图所示:
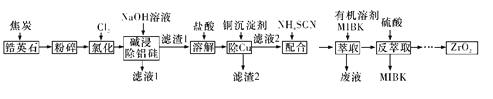
已知:Fe(SCN)3难溶于MIBK; Zr(SCN)4在水中的溶解度不大,易溶于MIBK。
请回答下列问题:
(1)ZrSiO4锆元素的化合价为____________。
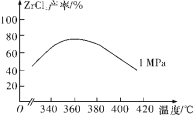
(2)“氯化”主反应为ZrSiO4(s)+2C(s)+4Cl2(g)![]() ZrCl4(g)+SiCl4(g)+2CO2(g) ΔH<0,相同时间内ZrCl4的产率随温度变化如图所示,由图可知“氯化”的最佳温度是________________。“氯化”过程中ZrCl4的产率随温度升高先增大后减小的原因是_________。
ZrCl4(g)+SiCl4(g)+2CO2(g) ΔH<0,相同时间内ZrCl4的产率随温度变化如图所示,由图可知“氯化”的最佳温度是________________。“氯化”过程中ZrCl4的产率随温度升高先增大后减小的原因是_________。
(3)写出Al2O3高温“氯化”过程中转化为AlCl3的化学方程式: ____________。
(4)本流程使用NaCN除铜,若盐酸“溶解”后溶液中的c(Cu2+)=0.01 mol·L-1,当溶液中Cu2+开始沉淀时,c(CN-)=______________。{已知Ksp[Cu(CN)2]=4.00×10-10}
(5)实验室进行“萃取”和“反萃取”的玻璃仪器是________。流程中“萃取”与“反萃取”的目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近的研究发现,复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,因而受到许多发达国家的青睐。MnFe2O4的制备流程如下:

(1)原料Fe(NO3)n中n=______,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为______。
(2)步骤二中“连续搅拌”的目的是______;步骤三中洗涤干净的标准是______。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:MnFe2O4![]() MnFe2O4﹣x+
MnFe2O4﹣x+![]() O2↑、MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑。请认真分析上述两个反应并回答下列问题:
O2↑、MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑。请认真分析上述两个反应并回答下列问题:
①若MnFe2O4﹣x中x=0.6,则MnFe2O4﹣x中Fe2+占全部铁元素的百分率为______。
②该热化学循环制氢法的优点有______(答两点即可)。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所陈述的事实与解释均正确的是
选项 | 实验操作及现象 | 实验结论 |
A | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
B | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
C | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中一定含有Fe2+ |
D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是
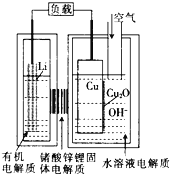
A.放电时,当电路中通过0.2mol电子的电量时,有0.2mol Li+透过固体电解质向Cu极移动,有标准状况下1.12L氧气参与反应
B.通空气时,铜被腐蚀,表面产生Cu2O
C.放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
D.整个反应过程,空气中的O2起了催化剂的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是____,每生成l mol Na2FeO4转移__mol电子。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO﹣、OH﹣、FeO42﹣、Cl﹣、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为______mol。
(3)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法净化水过程如图所示。下列说法中错误的是

A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的![]() 、
、![]() 、Cl通过阴离子树脂后被除去
、Cl通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com