
【题目】下列说法正确的是( )
A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O; c(NH4+) 由大到小的顺序是:①>②>③>④
B.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+) +c(H+) =c(S2―) +c (HS―)+c (OH―)
D.AgCl悬浊液中存在平衡: AgCl(s)![]() Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
【答案】A
【解析】
A.氨水部分电离出NH4+,所以四种溶液中c(NH4+)最小。硫酸铝铵中Al3+水解呈酸性,抑制NH4+水解、醋酸铵中CH3COO-水解呈碱性,促进NH4+水解、氯化铵中Cl-对NH4+水解无影响,所以四种溶液中c(NH4+)由大到小的顺序是①>②>③>④,A正确;
B.水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH为14-a或a,B错误;
C.H2S与Na2S混合溶液中电荷守恒式为c(Na+) +c(H+) =2c(S2―) +c (HS―)+c (OH―),C错误;
D.AgCl悬浊液中加入NaCl固体,沉淀溶解平衡向左移动,c(Ag+)减小、c(Cl-)增大,c(Na+)增大,D错误;
故答案选A。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】(一)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下列操作中可能使所测NaOH溶液的浓度数值偏低的是____________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL。
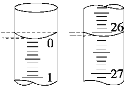
(3)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.50 | |
第二次 | 25.00 | 1.56 | 30.30 | |
第三次 | 25.00 | 0.22 | 26.76 | |
依据上表数据列式计算该NaOH溶液的物质的量浓度______________。
(二)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
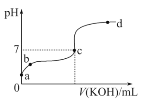
(1)c点溶液中的离子浓度大小顺序为________________。
(2)a、b、c三点中水的电离程度最大的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2 mol·L-1,含硝酸的浓度为1 mol·L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A.224 mLB.168 mL
C.112 mLD.89.6 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法不正确的是( )

A. 曲线Ⅰ代表盐酸的稀释过程 B. a溶液的导电性比c溶液的导电性强
C. a溶液中和氢氧化钠的能力强于b溶液 D. 将a、b两溶液加热至30℃, 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用 CuO 与 NH3 反应,研究 NH3 的某种性质并测定其组成, 设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
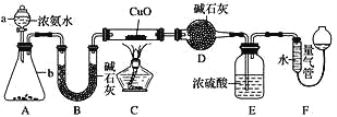
(1)仪器 a 的名称为 _____________。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有 _____________性,写出相应的化学方程式 ____________。
(3)E 装置中浓硫酸的作用 ____________。
(4)读取气体体积前,应对装置 F 进行的操作:_____________。
(5)实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________(用含 m、n 字母的代数式表示)
(6)在实验室中用图中 A 装置也可制取 SO2 气体:
①选用的药品可以是 _____________。
A.Na2SO3 溶液与 HNO3 B.Na2SO3 固体与浓 H2SO4
C.碳与浓 H2SO4 D.铜与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为 _________,表明 SO2 的氧化性比 I2___________(填“强或“弱”)。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是_________(填化学式)。
④某硫酸厂拟用含 Cr2O72-的酸性废水处理烟气中 SO2,反应后的铬元素以 Cr3+形式存在, 则反应中氧化剂和还原剂的物质的量之比是 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.浓度均为0.1mol/L的①NH4Fe(SO4)2;②NH4HSO4;③(NH4)2CO3;④CH3COONH4溶液中c(NH4+)的大小顺序为③>①>②>④
B.浓度均为0.1mol/L的CH3COONa溶液与NaClO溶液,溶液中阴、阳离子的总浓度前者大于后者
C.H3PO2为一元弱酸,在NaH2PO2水溶液中存在:c(H3PO2)+c(H2PO2-)=c(Na+)
D.0.1mol/L的Ca(HCO3)2溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。三位科学家因在锂离子电池研发领域作出的贡献而获2019年诺贝尔化学奖。完成下列填空:
(1)锂位于元素周期表的___。已知金属熔点:锂>钠>钾,请根据晶体结构理论解释原因:___。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式__,LiH中阴离子半径大于阳离子半径,其原因是___。
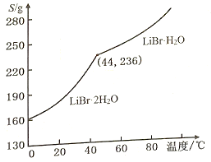
(3)工业上用Li2CO3制取锂的化合物及金属锂。用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:
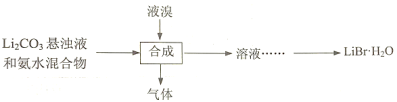
合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:____Li2CO3+____Br2+____NH3·H2O→______LiBr+______+ ______。
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:___、___、过滤、用乙醇洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是

A. Ka( HA)约为10-4
B. 当两溶液均稀释至![]() 时,溶液中
时,溶液中![]() >
>![]()
C. 中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D. 等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com