
【题目】(一)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下列操作中可能使所测NaOH溶液的浓度数值偏低的是____________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
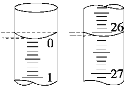
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______mL。
(3)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.50 | |
第二次 | 25.00 | 1.56 | 30.30 | |
第三次 | 25.00 | 0.22 | 26.76 | |
依据上表数据列式计算该NaOH溶液的物质的量浓度______________。
(二)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
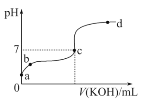
(1)c点溶液中的离子浓度大小顺序为________________。
(2)a、b、c三点中水的电离程度最大的是________。
【答案】D 26.10 c(NaOH)=0.1061 mol·L-1 c(K+)=c(CH3COO-)>c(H+)=c(OH-) c
【解析】
(一)(1)根据c(待测)=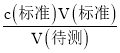 分析不当操作对V(标准)的影响,以此判断浓度的误差;
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(2)根据滴定管的结构和精确度以及测量的原理计算;
(3)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),接着根据盐酸和NaOH反应求出c(NaOH)。
(二)(1)结合c点溶液的成分和酸碱性判断;
(2)酸抑制水的电离程度,可水解的盐促进水的电离。
(一)(1)A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,标准液被稀释,造成V(标准)偏大,根据c(待测)=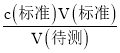 分析,测定c(待测)偏大,故A错误;
分析,测定c(待测)偏大,故A错误;
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=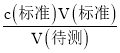 分析,测定c(待测)无影响,故B错误;
分析,测定c(待测)无影响,故B错误;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=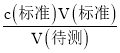 分析,测定c(待测)偏大,故C错误;
分析,测定c(待测)偏大,故C错误;
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=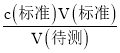 分析,测定c(待测)偏小,故D正确;
分析,测定c(待测)偏小,故D正确;
故答案为D;
(2)起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL;
(3)第二次实验误差较大,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=![]() mL=26.52mL,由HCl+NaOH=NaCl+H2O得0.02652L×0.1000 mol/L=0.025L×c(NaOH),解得:c(NaOH)≈0.1061mol/L;
mL=26.52mL,由HCl+NaOH=NaCl+H2O得0.02652L×0.1000 mol/L=0.025L×c(NaOH),解得:c(NaOH)≈0.1061mol/L;
(二)(1)c点pH=7,c(H+)=c(OH-),根据电荷守恒c(H+)+c(CH3COO-)=c(OH-)+c(K+)得c(CH3COO-)=c(K+),则c点溶液中的离子浓度大小顺序为c(CH3COO-)=c(K+)>c(H+)=c(OH-);
(2)a点是醋酸溶液,b点是醋酸和少量CH3COOK的混合溶液,c点可看做是CH3COOK和极少量CH3COOH的混合溶液,酸能抑制水的电离,酸的浓度越大,抑制能力越强,所以c点溶液中水的电离程度最大。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)=CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500 mL稀硝酸中加入一定量的铁粉,铁粉完全溶解后,放出NO 6.272L(标准状况下),同时溶液质量增加11.2g。下列判断不正确的是
A.原HNO3溶液的物质的量浓度为2.24 mol·L-1
B.原溶液中投入铁粉的物质的量是0.2 mol
C.反应后溶液中c(Fe3+):c(Fe2+)=2:3
D.反应后的溶液还可以溶解铜粉4.48g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇![]() 是重要的溶剂和替代燃料,工业上用CO和
是重要的溶剂和替代燃料,工业上用CO和![]() 在一定条件下制备
在一定条件下制备![]() 的反应为:
的反应为:![]() ,在体积为1L的恒容密闭容器中,充人
,在体积为1L的恒容密闭容器中,充人![]() 和
和![]() ,一定条件下发生上述反应,测得
,一定条件下发生上述反应,测得![]() 和
和![]() 的浓度随时间变化如图所示:
的浓度随时间变化如图所示:
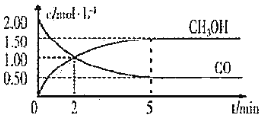
![]() 从反应开始至达到平衡,用氢气表示的平均反应速率
从反应开始至达到平衡,用氢气表示的平均反应速率![]() ______
______![]()
![]() 下列说法正确的是______
下列说法正确的是______![]() 填字母序号
填字母序号![]() 。
。
A.达到平衡时,CO的转化率为![]()
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前![]() 正
正![]() 逆
逆![]() ,2min后
,2min后![]() 正
正![]() 逆
逆![]()
![]() 该条件下反应的平衡常数
该条件下反应的平衡常数![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A.原子半径:Z>Y>X
B.气态氢化物的热稳定性:W>R
C.WX3和水反应生成的化合物是离子化合物
D.X元素在自然界中存在同素异形现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业制纯碱的部分物质转化示意图,下列说法错误的是
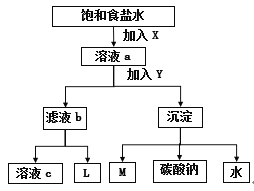
A. X是NH3,Y是CO2
B. M可在转化流程中循环利用
C. 若是联合制碱法,则L的主要成分是NH4Cl
D. 若是氨碱法,溶液c可在转化流程中循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述不正确的是( )
A. 含有氢原子数为0.4NA的CH3OH分子中含有的共价键数目为0.5NA
B. a g某气体含分子数为b,c g该气体在标准状况下体积为![]() L
L
C. 电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2NA
D. 常温下,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O; c(NH4+) 由大到小的顺序是:①>②>③>④
B.某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+) +c(H+) =c(S2―) +c (HS―)+c (OH―)
D.AgCl悬浊液中存在平衡: AgCl(s)![]() Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl―(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com