
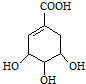
 ,D遇氯化铁变紫色,说明D中含有酚羟基,D的碳环上一氯代物只有两种,应为对称结构,则D可能为
,D遇氯化铁变紫色,说明D中含有酚羟基,D的碳环上一氯代物只有两种,应为对称结构,则D可能为 ,E为
,E为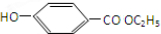 ,以此解答;
,以此解答; ,D遇氯化铁变紫色,说明D中含有酚羟基,D的碳环上一氯代物只有两种,应为对称结构,则D可能为
,D遇氯化铁变紫色,说明D中含有酚羟基,D的碳环上一氯代物只有两种,应为对称结构,则D可能为 ,E为
,E为 ,
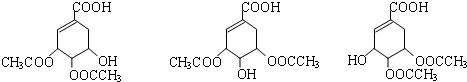
, ,
,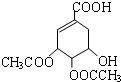 或者
或者 或者
或者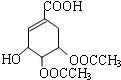 ;
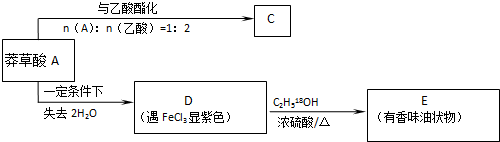
; 脱去2个水生成
脱去2个水生成 ,则反应类型是消去反应,故答案为:消去反应;
,则反应类型是消去反应,故答案为:消去反应; ,其中羧基可与碳酸氢钠反应,酚羟基酸性比碳酸弱,所以不与碳酸氢钠反应,故方程式为
,其中羧基可与碳酸氢钠反应,酚羟基酸性比碳酸弱,所以不与碳酸氢钠反应,故方程式为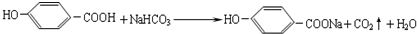 ,
,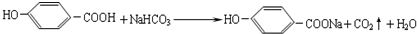 ;
;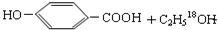
| 浓硫酸 |
| △ |
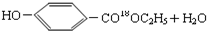 ,
,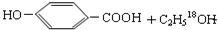
| 浓硫酸 |
| △ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
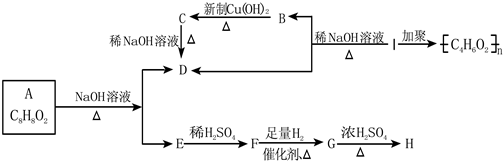 其中F能与FeCl3溶液显紫色,I为一种不饱和酯.
其中F能与FeCl3溶液显紫色,I为一种不饱和酯.查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 性质或原子结构 |
| A | 原子核内只有一个质子 |
| B | 单质是空气中含量最多的气体 |
| X | 原子的最外层电子数是次外层电子数的3倍 |
| Y | 短周期元素中原子半径最大的元素 |
| Z | 最高正化合价与最低负化合价的代数和为6 |
| 实验操作 | 实验现象 | 结论及解释 |
| ①取少量NaBr 溶液于试管中,滴加 ②再加入少量CCl4,振荡,静置. | ①溶液由无色变为橙黄色. ②溶液分层, | 氧化性:Z 单质>Br2 离子方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
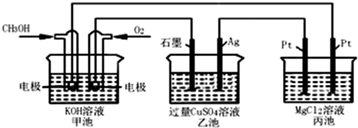
| A、甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B、甲池通入CH3OH的电极反应为CH3OH-6e?+2H2O═CO32?+8H+ |
| C、反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D、甲池中消耗224 mL(标准状况下)O2,此时乙池中银电极上产生1.28g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2mol?L-1?min-1 |
| B、1.0 mol?L-1?min-1 |
| C、0.5 mol?L-1?min-1 |
| D、0.4 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、①③⑤ |
| C、①②④⑤ | D、①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com