
【题目】(1)实验测得16g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧热的热化学方程式:_______________________.
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1.有关键能数据如表:
化学键 | H-H | N-H | N≡N |
键能(kJ/mol) | 436 | 391 | 945 |
试根据表中所列键能数据估算a的数值_______________.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:△H=____________________.
(4)在微生物作用下,NH4+经过两步反应被氧化成NO3﹣。两步反应的能量变化示意图如图:
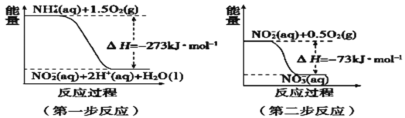
第一步反应是________反应(填“放热”或“吸热”),原因是_________________________
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol -93 +226.7 kJmol﹣1 放热 反应物总能量高于生成物总能量
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol -93 +226.7 kJmol﹣1 放热 反应物总能量高于生成物总能量
【解析】
(1)燃烧热是1mol可燃物完全燃烧生成温度氧化物放出的热量,根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)反应热等于反应物的总键能-生成物的总键能求算;(3)可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式;
(4)当反应物的总能量大于生成物的总能量,反应是放热的。
(1)16gCH3OH在氧气中燃烧生成CO2和液态水,放出363.25kJ热量,32g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出726.5kJ热量,则△H=726.5kJ/mol,则燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol,故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol;
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ/mol;
(2)N2(g)+3H2(g)2NH3(g)△H=945+436×3-391×6 kJmol﹣1=-93 kJmol﹣1,因此a=93,故答案为:93;
(3)已知:①C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1 ②2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1 ③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2599kJmol﹣1 ,2C(s,石墨)+H2(g)=C2H2(g)的反应热可以根据①×2+②×![]() ③×
③×![]() 得到,△H=2×(393.5 kJmol﹣1)+(571.6 kJmol﹣1)×
得到,△H=2×(393.5 kJmol﹣1)+(571.6 kJmol﹣1)×![]() (2599 kJmol﹣1)×
(2599 kJmol﹣1)×![]() =+226.7 kJmol﹣1,故答案为:+226.7 kJmol﹣1;
=+226.7 kJmol﹣1,故答案为:+226.7 kJmol﹣1;
(4)因为△H=273kJ/mol<0,则反应为放热反应,反应物的总能量大于生成物的总能量,
故答案为:放热,反应物总能量高于生成物总能量。


科目:高中化学 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数![]() (X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是
(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是![]()
![]()
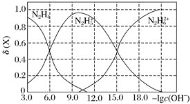
A.Kb1(N2H4)=10-6
B.反应![]() 的pK=9.0(已知:Pk=-lgK)
的pK=9.0(已知:Pk=-lgK)
C.N2H5Cl溶液中c(H+)>c(OH-)
D.N2H5Cl溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素。A与另外四种元素既不在同一周期,也不在同一主族。B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图。
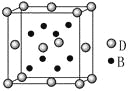
请回答下列问题:
(1)C-的电子排布式为_______;E元素原子的价电子排布式为________。
(2)元素B与氮元素可以形成化合物NB3,其中N-B键的化学键类型为________,根据价层电子对互斥理论可以判断NB3的空间构型为________,NB3分子中N原子的杂化方式为________杂化。
(3)A、B形成的化合物AB的相对分子质量比A、C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是_________________________。
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为______________。
(5)含有D元素的化合物焰色反应为______色,焰色反应的原理是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g) ![]() 2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。请回答下列问题:
2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。请回答下列问题:

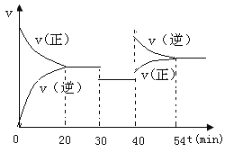
(1)0~20min,A的平均反应速率为_________________;8min时,v(正)___v(逆)(填:>、=或<)
(2)反应方程式中的x=_______,30min时改变的反应条件是________________________。
(3)20~30min时反应的平衡常数_______30~40min时反应的平衡常数(填:>、=或<)。
(4)该反应的正反应为________(填:“放热”或“吸热”)反应。
(5)反应过程中B的转化率最大的时间段是__________________min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1 CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g)△H3 4Fe(s)+3O3(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0B.△H1>△H2
C.△H1=△H2+△H3D.△H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:
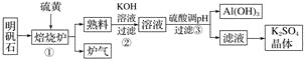
据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(用NOx表示)是大气污染的重要因素,根据NOx的来源和性质特点,已开发出多种化学治理其污染的方法。
(1)汽车尾气中的NO2是城市大气污染的主要污染物之一。在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2→2NO+2O,②2NO+O2→2NO2,③O+O2→O3。下列关于该反应过程及生成物的叙述正确的是____(填序号)。
A.NO2起催化作用
B.NO起催化作用
C.NO2只起氧化作用
D.O3与O2互为同素异形体
(2)汽车尾气中的CO来自于____,NO来自于____。
(3)汽车尾气中的CO、NOx可在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:_____。
(4)工业尾气中氮氧化物常采用碱液吸收法处理。NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,该反应的离子方程式为____;1molNO2被完全吸收时,转移电子的物质的量为____。NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)HSO![]() 的电离平衡常数表达式K=______________________________。
的电离平衡常数表达式K=______________________________。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第20届中国国际工业博览会上,华东师范大学带来的一种“锌十碘”新型安全动力电池亮相工博会高校展区。该新型安全动力电池无污染、高安全、长寿命且具有合适的充电时间,可以应用于日常生活、交通出行等各个领域。已知该电池的工作原理如图所示。下列有关说法正确的是( )
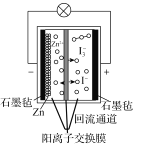
A.正极反应式为I3--2e-=3I-
B.6.5gZn溶解时,电解质溶液中有0.2mol电子移动
C.转移1mol电子时,有1molZn2+从左池移向右池
D.“回流通道”可以减缓电池两室的压差,避免电池受损
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com