
【题目】25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)HSO![]() 的电离平衡常数表达式K=______________________________。
的电离平衡常数表达式K=______________________________。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________。
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】如下图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是
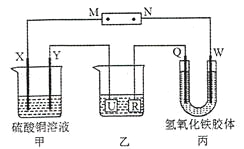
A.电源的M 极为正极
B.甲装置中溶液的pH 减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1︰1
D.欲用乙装置给铜镀银,U 极应该是Ag,电镀液选择AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验测得16g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧热的热化学方程式:_______________________.
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1.有关键能数据如表:
化学键 | H-H | N-H | N≡N |
键能(kJ/mol) | 436 | 391 | 945 |
试根据表中所列键能数据估算a的数值_______________.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:△H=____________________.
(4)在微生物作用下,NH4+经过两步反应被氧化成NO3﹣。两步反应的能量变化示意图如图:
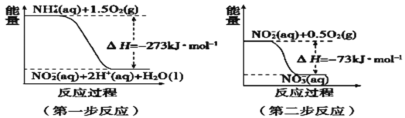
第一步反应是________反应(填“放热”或“吸热”),原因是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国历史悠久,有灿烂的青铜文明,出土大量的青铜器。研究青铜器中(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )
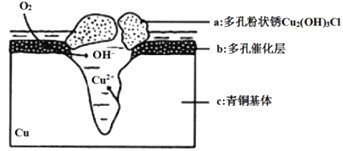
A.青铜器发生电化学腐蚀,图中c作负极,被氧化
B.正极发生的电极反应为O2+4e-+2H2O=4OH-
C.环境中的C1-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
D.若生成2 mol Cu2(OH)3Cl, 则理论上消耗标准状况下O2的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:

下列说法正确的是
A. “灼烧”可在石英坩埚中进行
B. 母液中的溶质是K2CO3、KHCO3、KCl
C. “结晶”环节采用加热蒸发结晶的方法
D. “转化”反应中,生成的KMnO4和MnO2的物质的量之比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。如图是该反应生成1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式__________。

(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应Ⅰ:2NO(g)![]() N2O2(g)(快) ΔH1<0,v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
N2O2(g)(快) ΔH1<0,v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反应Ⅱ:N2O2(g)+O2(g)![]() 2NO2(g)(慢)ΔH2<0,v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2(NO2)。
2NO2(g)(慢)ΔH2<0,v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2(NO2)。
①一定条件下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。反应Ⅰ的活化能EⅠ___________(填“>”“<”或“=”)反应Ⅱ的活化能EⅡ。
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。反应Ⅰ的活化能EⅠ___________(填“>”“<”或“=”)反应Ⅱ的活化能EⅡ。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数__________(填“大于”“小于”或“等于”)k2逆增大的倍数。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
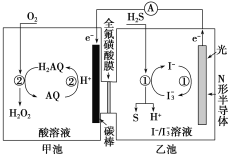
①装置中H+向_______池迁移。
②乙池溶液中发生反应的离子方程式:_______。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25 ℃,某废液中c(Mn2+)=0.02 mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1 mol·L-1,此时pH约为_______(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:Ka1=1.5×10-7,Ka2=6.0×10-15,lg 6=0.8)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
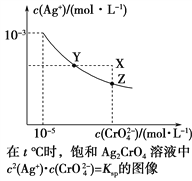
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq) ![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)平衡常数K=6.25×107
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
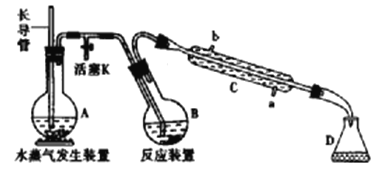
(1)A的名称是___________,长导管用于平衡压强,实验过程中其下端___________(填“能”或“不能”)在液面以上。
(2)仪器C是直形冷凝管,实验过程中,冷却水应从___________口出。(填“a”或“b")
(3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏:若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是___________。
(5)B中加入一定体积高氯酸和1.00g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a.醋酸 b.硝酸 c.磷酸 d.硫酸
②D中主要反应的离子方程式为_________________________________。
(6)向馏出液中加入25.00mL0.100mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L -1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1络合),消耗EDTA标准溶液20.00mL,则氟化稀土样品中氟的质量分数为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com