
【题目】如下图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深。下列说法中不正确的是
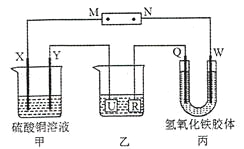
A.电源的M 极为正极
B.甲装置中溶液的pH 减小
C.甲装置的两个电极上都有单质生成且物质的量之比为1︰1
D.欲用乙装置给铜镀银,U 极应该是Ag,电镀液选择AgNO3溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是

A.原子半径:W > Z > Y > X
B.气态氢化物热稳定性:Y > Z > W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数![]() (X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是
(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是![]()
![]()
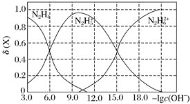
A.Kb1(N2H4)=10-6
B.反应![]() 的pK=9.0(已知:Pk=-lgK)
的pK=9.0(已知:Pk=-lgK)
C.N2H5Cl溶液中c(H+)>c(OH-)
D.N2H5Cl溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g) ![]() NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
NH3(g) △H 的反应机理如图所示,图中“吸”表示各气态物质在催化剂表面吸附。下列说法错误的是
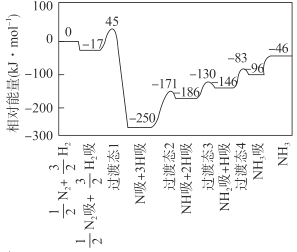
A.该反应的△H = -46 kJ·mol- 1
B.该反应机理中最大活化能为79 kJ·mol- 1
C.升高温度,该反应过渡态的能量会增大
D.该反应达到平衡后增大压强反应正向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,充分燃烧一定量的丁烷放出热量161.9kJ,经测定完全吸收生成的CO2需消耗5mol/L的KOH溶液100ml,恰好生成正盐,则此条件下热化学方程式:C4H10(g)+![]() O2(g)→4CO2(g)+5H2O(g)的△H为( )
O2(g)→4CO2(g)+5H2O(g)的△H为( )
A. +2590.4kJ/mol B. ﹣2590.4kJ/mol C. +1295.2kJ/mol D. ﹣1295.2kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
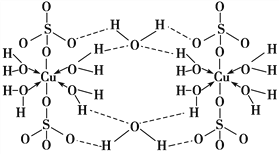
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素。A与另外四种元素既不在同一周期,也不在同一主族。B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图。
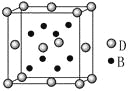
请回答下列问题:
(1)C-的电子排布式为_______;E元素原子的价电子排布式为________。
(2)元素B与氮元素可以形成化合物NB3,其中N-B键的化学键类型为________,根据价层电子对互斥理论可以判断NB3的空间构型为________,NB3分子中N原子的杂化方式为________杂化。
(3)A、B形成的化合物AB的相对分子质量比A、C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是_________________________。
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为______________。
(5)含有D元素的化合物焰色反应为______色,焰色反应的原理是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g) ![]() 2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。请回答下列问题:
2C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。请回答下列问题:

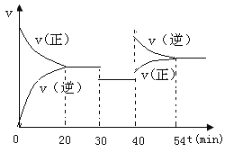
(1)0~20min,A的平均反应速率为_________________;8min时,v(正)___v(逆)(填:>、=或<)
(2)反应方程式中的x=_______,30min时改变的反应条件是________________________。
(3)20~30min时反应的平衡常数_______30~40min时反应的平衡常数(填:>、=或<)。
(4)该反应的正反应为________(填:“放热”或“吸热”)反应。
(5)反应过程中B的转化率最大的时间段是__________________min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
(1)HSO![]() 的电离平衡常数表达式K=______________________________。
的电离平衡常数表达式K=______________________________。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com