
【题目】室温下,一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的Na2SO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11(忽略反应前后的体积变化),则Ba(OH)2溶液与Na2SO4溶液的体积比是( )
A.1:9B.1:1C.1:2D.1:4
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________。
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3 mol/L的AgNO3溶液,乙池为1 mol/L的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是
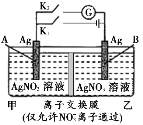
A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
B.断开K1、闭合K2,当转移0.1 mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是 ( )

A. γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B. α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D. 三种同素异形体的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电化学的实验事实正确的是( )
出现环境 | 实验事实 | |
A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
B | 电解CuCl2溶液 | 电子经过负极→阴极 |
C | 弱酸性环境下钢铁腐蚀 | 负极处产生H2,正极处吸收O2 |
D | 将钢闸门与外加电源负极相连 | 牺牲阳极阴极保护法,可防止钢闸门腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是人体中一种重要元素,一般情况下,钠约占成人体重的0.15%。钠元素对应的化合物因组成与结构性质差异很大。
(1)钠原子核外电子共占据_______个轨道,写出同一周期中原子核外M层上有2个未成对电子的元素其原子最外层电子排布式_______。
(2)氯化钠的熔点比氯化钾的_______(填“高”或“低”),原因是________。
(3)实验室可用浓氨水与氢氧化钠固体反应制取氨气,试用平衡原理分析氢氧化钠的作用:___。
(4)氟化钠溶液中,不存在的微粒间作用力是_________(填标号)。
A.离子键 B.共价键 C.金属键 D.范德华力
(5)卡斯纳法制取金属钠的原理是:以氢氧化钠为原料,放入铁质容器中熔化,在稀有气体的保护下,以镍为阳极,铁为阴极,在阴极析出金属钠。写出反应的化学方程式为:_______。其中,氧化产物是:_____,若反应转移0.8mol电子,至少消耗______g NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求回答下列问题
(1)硫酸铁溶液显酸性的原因_____(用离子方程式表示).
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合溶液中c(CH3COO﹣)=c(Na+),则混合后溶液显_____性.
(3)浓度均为0.1mol/L①氯化铵②醋酸铵③硫酸氢铵④氨水四种溶液中,c(NH4+)由大到小的顺序_____(填序号).
(4)将化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)B(g)+nC(g),反应到3min时,容器内A的浓度为0.8mol/L,测得这段时间内,平均速率ν(C)=0.6mol/(Lmin),则化学方程式中的n值为_____,ν(B)=_____,此时A的分解率为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)(氟只有两种价态:-1,0)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O![]() 2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
A. NF3是氧化剂,H2O是还原剂
B. 若1mol NF3被氧化,反应转移电子数为2NA
C. 若生成0.4molHNO3,则转移0.4mol电子
D. 氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com