
【题目】聚丙烯酸甲酯可用作胶黏剂、乳胶漆等,可通过如图所示物质转化合成得到:
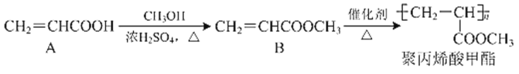
(1)化合物A能使酸性KMnO4溶液褪色,是因为其中含有_____(填官能团名称),能与NaHCO3反应,是因为其中含有_____(填官能团名称)。
(2)化合物A→B的反应类型为_____反应,该反应中除B外还有_____(填化学式)生成。
(3)化合物B→聚丙烯酸甲酯的反应类型为_____反应。
(4)CH3OH与乙醇的化学性质相似,CH3OH与Na反应所得化合物为_____。
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
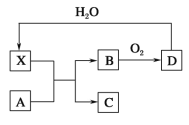
A.X使蔗糖变黑主要体现了X的吸水性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可观察到有白色沉淀产生
D.由B转化为D的反应是工业制备X过程中的重要反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2 =N2+H2O,下列关于该电池工作时的说法正确的是( )
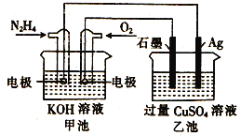
A.该装置工作时,甲池中溶液的pH增大
B.乙池中负极反应为2Ag-2e-+SO42-=Ag2SO4
C.甲池正极反应O2+4e-+4H+=2H2O
D.当甲池中消耗0.05molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3-CH=CH2+HBr→CH3-CHBr-CH3(主要产物)。1mol某芳香烃A充分燃烧后可以得到8mol CO2和4mol H2O。该烃A在不同条件下能发生如下所示的一系列变化。
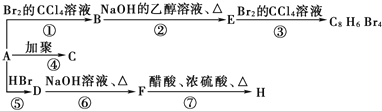
回答下列问题:
(1)A的分子式为_____________,E中官能团名称为___________。
(2)F的结构简式为_______________,③的反应类型为______________。
(3)写出下列反应的化学方程式:
② ________________________________;
④ ________________________________;
(4)下列关于F的说法正确的是_____(填序号)。
a.能发生消去反应 b.能与金属钠反应
c.1mol F最多能和3mol氢气反应 d.分子式是C8H9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 。下列说法正确的是
。下列说法正确的是
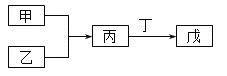
A.若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能具有漂白性
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲![]() 丙
丙![]() 戊
戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某兴趣小组对含有泥沙的粗盐进行提纯实验的流程图,请回答下列问题。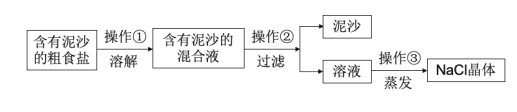
(1)操作②中用到的玻璃仪器是__。
(2)写出操作③中玻璃棒的作用__。
(3)若实验所得NaCl的产率偏低,则可能的原因__(填选项)。
A.过滤时滤纸有破损
B.蒸发时没有用玻璃棒搅拌
C.溶解含泥沙的粗盐时,加入水量不足
D.所得氯化钠晶体没有烘干,带有水分
E.过滤后的滤纸是湿的,纸上的水溶解了一些氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
 试回答:(1)操作Ⅰ为_____________(填写操作名称)。
试回答:(1)操作Ⅰ为_____________(填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为__________________________________。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是________________________________。
(4)操作Ⅲ的顺序依次为:_______________、冷却结晶、过滤 、__________、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需___________。
②该同学设计的下列滴定方式,最合理的是____________(夹持部分略去)(填字母序号)。
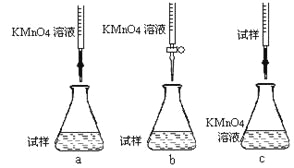
③滴定时发生反应的离子方程式为:_______________________________________。
④判断此滴定实验达到终点的方法是_____________________________;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果________(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com