
【题目】下列叙述正确的是( )
A.用甘氨酸(H2N﹣CH2﹣COOH)和丙氨酸(![]() )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
B.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
C.苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构
D.向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同
【答案】A
【解析】
A. 氨基酸生成二肽,就是两个氨基酸分子脱去一个水分子。当同种氨基酸脱水,生成2种二肽;当异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽,因此共生成4种二肽,A正确;
B. 根据酯形成脱水方式是:酸脱羟基醇脱氢,酯的水解是酯化反应的逆反应,则在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH,B错误;
C. 苯的二氯代物有3种,说明苯分子中不存在单双键交替结构,C错误;
D. 向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,前者是发生盐析,后者是蛋白质的变性,因此其作用原理不相同,D错误;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2LCl2溶于水生成Cl-的数目为0.5NA
B.常温常压下,3.4g羟基(-OH)所含的电子数目为1.8NA
C.等物质的量的A1分别与足量盐酸和NaOH溶液反应,转移的电子数均为3NA
D.25℃时,1LpH=8的CH3COONa溶液中,水电离出的OH-数目为10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2是一种重要的光催化剂。以钛酸酯Ti(OR)4为原料制备纳米TiO2的步骤如下:
①组装装置如下图所示,保持温度约为65℃,先将30mL钛酸四丁酯[Ti(OC4H9)4]加入盛有无水乙醇的三颈烧瓶,再加入3mL乙酰丙酮,充分搅拌;
②将含水20%的乙醇溶液缓慢滴入三颈烧瓶中,得到二氧化钛溶胶;
③将二氧化钛溶胶干燥得到二氧化钛凝胶,灼烧凝胶得到纳米TiO2。
已知,钛酸四丁酯能溶于除酮类物质以外的大部分有机溶剂,遇水剧烈水解;Ti(OH)4不稳定,易脱水生成TiO2,回答下列问题:
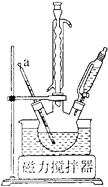
(1)仪器a的名称是_______,冷凝管的作用是________。
(2)加入的乙酰丙酮可以减慢水解反应的速率,其原理可能是________(填标号)。
a.增加反应的焓变 b.增大反应的活化能
c.减小反应的焓变 d.降低反应的活化能
制备过程中,减慢水解反应速率的措施还有________。
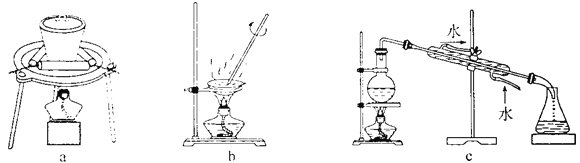
(3)步骤②中制备二氧化钛溶胶的化学方程式为________。下图所示实验装置中,可用于灼烧二氧化钛凝胶的是________(填标号)。
(4)测定样品中TiO2纯度的方法是:精确称取0.2000 g样品放入锥形瓶中,加入硫酸和硫酸铵的混合溶液,加强热使其溶解。冷却后,加入一定量稀盐酸得到含TiO2+的溶液。加入金属铝,将TiO2+全部转化为Ti3+。待过量的金属铝完全溶解并冷却后,加入指示剂,用0.1000 mol·L-lNH4Fe(SO4)2溶液滴定至终点。重复操作2次,消耗0.1000 mol·L-1 NH4Fe(SO4)2溶液的平均值为20.00 mL(已知:Ti3+ +Fe3++H2O=TiO2+ +Fe2+ +2H+)。
①加入金属铝的作用除了还原TiO2+外,另一个作用是________________。
②滴定时所用的指示剂为____________(填标号)
a.酚酞溶液 b. KSCN溶液 c. KMnO4溶液 d.淀粉溶液
③样品中TiO2的质量分数为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:H2(g)+ I2(g)![]() 2HI(g) △H ﹤0 达平衡后,下列说法正确的是
2HI(g) △H ﹤0 达平衡后,下列说法正确的是
A. 增加H2的量,反应放出的热量减小 B. 升高温度,反应放出的热量增加
C. 增大压强,反应放出的热量不变 D. 加入催化剂,反应的△H减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ti及其化合物在航天工业上有重要的应用,回答下列问题:
(1)基态Ti原子的价电子排布式为_______,基态Ti原子核外存在_______对自旋相反的电子。
(2)TiCl4熔点为23℃,沸点为136℃,TiCl4晶体属于_______晶体。TiCl4可由TiO2与COCl2在一定条件下反应得到,反应的化学方程式为_______,COCl2中共价键类型为_______,C原子的杂化轨道类型是_______,与COCl2互为等电子体的分子为_______。C、O、Cl的电负性由小到大的顺序为_______。
(3)金红石型TiO2晶胞如图,如果晶胞的边长为apm,则它的密度为_______g/cm3(列出计算式即可)。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇在一定条件下可以被氧气氧化为乙醛,下面是一位同学对这个反应的实验设计。请你解答其中的问题。实验装置如图:
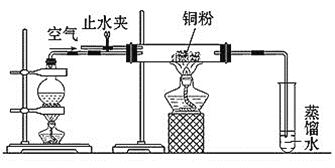
操作步骤:
①加热铜粉末,同时鼓入空气。
②加热烧瓶。
③停止加热烧瓶,然后再鼓入空气。
④再加热烧瓶。
⑤停止加热,取下试管,验证产物。
(1)该实验装置在实验前需要检验装置气密性,请你叙述检验方法:________。
(2)烧瓶中盛装的液体是____,为了防止反应的____,在烧瓶中需要事先放置几片碎瓷片。
(3)操作步骤②时,玻璃管中粉末的颜色由___色变为___色,发生该反应的化学方程式是________。
(4)操作⑤中,在试管中的溶液中滴入____,加热后试管内出现红色沉淀,实验中提供了酒精灯、火柴、胶头滴管等,为完成该实验,还需要一种非玻璃仪器。该仪器的名称是___。
(5)当该同学把这个实验设计呈交老师时,老师以该实验方法存在安全隐患而否定了他的实验方法。请你评价该实验可能存在的危险是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据是
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 | |
实 验 方 案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡, 试管中出现浑浊 | 测得ΔH为ΔH1、ΔH2的和 | H2与O2的体积比约为2︰1 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;制取Cl2并通入滤液氧化Br-,用苯萃取分液。其中部分操作的装置如图所示,下列叙述正确的是( )
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌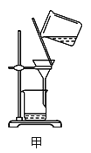
B.用装置乙在空气中高温灼烧Ag2S制取Ag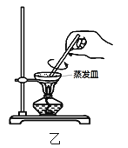
C.用装置丙制备用于氧化滤液中Br-的Cl2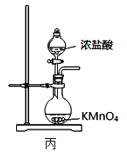
D.用装置丁分液时,先放出水相再放出有机相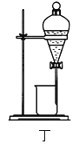
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com