
【题目】在下列条件下,两种气体的分子数一定相等的是
A.同质量、不同密度的N2和C3H6;B.同温度、同体积的O2和N2;
C.同体积、同密度的CO和C2H4;D.同压强、同体积的O2和N2。
【答案】C
【解析】
利用阿伏加德罗定律和阿伏加德罗推论进行分析。
利用n=![]() ,即分子数相等,气体物质的量相等,
,即分子数相等,气体物质的量相等,
A. N2的摩尔质量为28g·mol-1,C3H6的摩尔质量为42g·mol-1,即同质量的两种气体,其气体物质的量不同,故A错误;
B. 根据PV=nRT,同温度、同体积的O2和N2,因压强不知是否相等,因此无法推出N2和O2物质的量是否相等,故B错误;
C. 根据密度的定义,同体积、同密度,推出这两种气体质量相等,CO和C2H4的摩尔质量都是28g·mol-1,推出CO和C2H4物质的量也相等,故C正确;
D. 根据PV=nRT,同压强,同体积,不知温度是否相等,因此无法判断O2和N2物质的量是否相等,故D错误;
答案:C。


科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是一种不稳定的物质,它的分子组成可用OXFY表示。10mLA气体能分解生成15mL O2和10mL F2(同温同压下)
(1)A的化学式是____________,推断时依据的定律是___________
(2)已知A分子中x个氧原子呈…-O-O-O-…链状排列,则A分子的电子式是_________结构式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=﹣Q1kJmol﹣1
2H2(g)+O2(g)=2H2O(g)ΔH=﹣Q2kJmol﹣1,
2H2(g)+O2(g)=2H2O(l) ΔH2=﹣Q3kJmol﹣1
常温下,取体积比2∶3的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2B.0.2Q1+0.05Q2C.0.2Q1+0.15Q3D.0.2Q1+0.3Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药。
(1)Ni能与CO形成配合物Ni(CO)4,配体CO中提供孤电子对的是C原子,其理由可能是__;该配合物分子中σ键与π键数目之比为__。
(2)①ClO4-的空间构型是___。
②写出与ClO4-互为等电子体的一种分子和一种离子:__、__。(填化学式)
(3)化学式中CHZ为碳酰肼,其结构为![]() ,它是一种新型的环保锅炉水除氧剂。
,它是一种新型的环保锅炉水除氧剂。
①碳酰肼中氮元素的化合价为__,碳原子的杂化轨道类型为__。
②碳酰肼可以由碳酸二甲酯(![]() )和肼(N2H4)反应制得,有关的化学方程式为__。
)和肼(N2H4)反应制得,有关的化学方程式为__。
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。
①比较次氯酸和高氯酸的酸性,并说明理由:___。
②如图为NiO晶胞,若晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个Ni2+距离最近的Ni2+数目为c,则a:b:c=__。
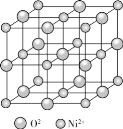
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿佛加德罗常数为NA,下列叙述正确的是
A.1molD2O所含质子数为12NA;B.1molNa2O2与足量水反应转移电子数为2NA;
C.10g 氖气所含原子数为0.5NA;D.标况下22.4L正戊烷含氢原子数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成份为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如图:
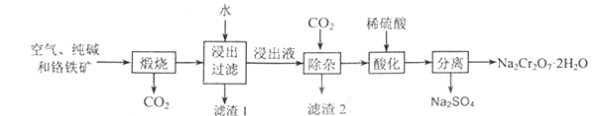
(1)煅烧过程中,铬铁矿中的Al2O3与纯碱反应的化学方程式为:____。
(2)滤渣1的成分为_____,滤渣2的成分为_____。
(3)该工艺中某种产物可以再利用,该物质的化学式为:_____。
(4)酸化时发生的反应为:2CrO42-+2H+![]() Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有
Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有![]() 转化为Cr2O72-。
转化为Cr2O72-。
①酸化时发生反应的平衡常数的表达式为K=_____。
②酸化后所得溶液中c(Cr2O72-)=____。
(3)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于____mol·L-1,后续废水处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。写出酸性条件下CrO42-与绿矾反应的离子方程式____。
Cr(OH)3。写出酸性条件下CrO42-与绿矾反应的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是( )
A. 已知氟利昂12的结构式为![]() ,该分子是平面形分子
,该分子是平面形分子
B. 1mol苹果酸[HOOCCH(OH)CH2COOH]可与3molNaHCO3发生反应
C. 用甲苯分别制取TNT、邻溴甲苯所涉及的反应均为取代反应
D. ![]() 的一氯代物共有5种(不考虑立体异构)
的一氯代物共有5种(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com