
【题目】化合物A是一种不稳定的物质,它的分子组成可用OXFY表示。10mLA气体能分解生成15mL O2和10mL F2(同温同压下)
(1)A的化学式是____________,推断时依据的定律是___________
(2)已知A分子中x个氧原子呈…-O-O-O-…链状排列,则A分子的电子式是_________结构式是_________。
【答案】O3F2 阿伏加德罗定律和质量守恒定律 ![]() F-O-O-O-F
F-O-O-O-F
【解析】
(1)根据阿伏加德罗定律气体的体积比等于物质的量之比,物质的量之比等于计量数之比,再根据质量守恒可以写出分解方程式为2OxFy=3O2+2F2,则A化学式为O3F2;
(2)该分子中含3个O原子,根据“A分子中X个氧原子是…-O-O-O-…链状排列”知答案。
(1)根据阿伏加德罗定律气体的体积比等于物质的量之比,物质的量之比等于计量数之比,再根据质量守恒可以写出分解方程式为2OxFy=3O2+2F2,则A化学式为O3F2,故答案为:O3F2,阿伏加德罗定律和质量守恒定律;
(2)该分子中含3个O原子,根据“A分子中X个氧原子是…-O-O-O-…链状排列”知,两个F原子位于该分子的两端,所以该分子的结构式为F-O-O-O-F,因此其电子式为![]() ,故答案为:
,故答案为:![]() ,F-O-O-O-F。
,F-O-O-O-F。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法错误的是 ( )
A.28克氮气所含的原子数目为2NA;
B.在标况下,0.5NA氯分子所占体积约是11.2L;
C.只有在标况下NA氧气分子的物质的量才是1mol;
D.在70℃、1×105Pa下,46克NO2与标况下46克四氧化二氮均含有3NA原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)气体的燃烧热为ΔH=-1299.6kJ·mol-1,分别写出表示乙炔燃烧反应的热化学方程式和表示乙炔燃烧热的热化学方程式____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+=I2+5SO42-+H2O,生成的I2可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
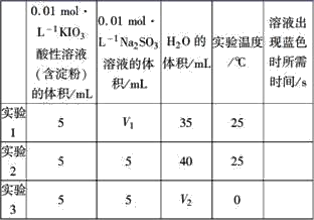
该实验的目的是_________;表中V2=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在接触法制硫酸中,将SO2与空气按1∶3的体积比混合(空气中氮气与氧气的体积比为4∶1)后进入接触室,在一定条件下反应达到平衡后,气体总体积减少为原来的88%(体积均在相同情况下测定),求反应达到平衡时SO2的转化率_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微粒的结构示意图为: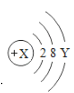
(1)X表示_________Y表示_______
(2)当Y=8时,若该微粒为中性原子,则X=_______
(3)当Y=8时,若该微粒带有两个单位负电荷,则该微粒符号为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类似于卤素X2与苯的同系物的反应,卤代烃亦可进行类似反应,如均三甲苯与氟乙烷的反应。它们的反应经历了中间体(Ⅰ)这一步,中间体(Ⅰ)为橙色固体,熔点-15℃,它是由负离子BF4-与一个六元环的正离子组成的,正离子中正电荷平均分配在除划*号碳原子以外的另五个成环的碳原子上,见图(Ⅰ)虚线。
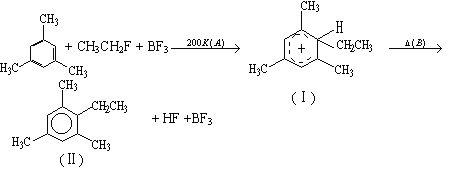
(1)从反应类型看,反应A属于___,反应B属于___,全过程属于___。
(2)中间体(Ⅰ)中画*号的碳原子的立体构型与下列化合物中画*号碳原子接近的是(_____)
A.*CH≡CH B.CH3*CH2CH3 C.![]() D.
D.![]()
(3)模仿上题,完成下列反应(不必写中间体,不考虑反应条件,但要求配平)。
①![]() +
+![]() →___
→___
②![]() (过量)+CHCl3 →___
(过量)+CHCl3 →___
③![]() + →
+ →![]() +HBr___
+HBr___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列条件下,两种气体的分子数一定相等的是
A.同质量、不同密度的N2和C3H6;B.同温度、同体积的O2和N2;
C.同体积、同密度的CO和C2H4;D.同压强、同体积的O2和N2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,三硫代碳酸钠(Na2CS3)是玫瑰红色针状固体,与碳酸钠性质相近。在工农业生产中有广泛的用途。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na2CS3的性质
(1)向Na2CS3溶液中滴入酚酞试液,溶液变红色。用离子方程式说明溶液呈碱性的原因_________。
(2)向Na2CS3溶液中滴加酸性KMnO4溶液,紫色褪去。该反应中被氧化的元素是__________。
实验二:测定Na2CS3溶液的浓度
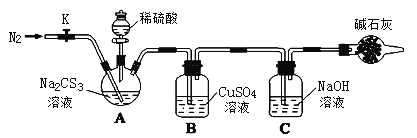
按如图所示连接好装置,取50.0mLNa2CS3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
已知:Na2CS3+ H2SO4=Na2SO4+ CS2+ H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,密度1.26g/mL,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(1)盛放碱石灰的仪器的名称是_______,碱石灰的主要成分是______(填化学式)。
(2)C中发生反应的离子方程式是____________。
(3)反应结束后打开活塞K,再缓慢通入N2一段时间,其目的是_________。
(4)为了计算Na2CS3溶液的浓度,对充分反应后B中混合物进行过滤、洗涤、干燥、称重,得8.4g 固体,则三颈瓶中Na2CS3的物质的量浓度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com