
【题目】类似于卤素X2与苯的同系物的反应,卤代烃亦可进行类似反应,如均三甲苯与氟乙烷的反应。它们的反应经历了中间体(Ⅰ)这一步,中间体(Ⅰ)为橙色固体,熔点-15℃,它是由负离子BF4-与一个六元环的正离子组成的,正离子中正电荷平均分配在除划*号碳原子以外的另五个成环的碳原子上,见图(Ⅰ)虚线。
(1)从反应类型看,反应A属于___,反应B属于___,全过程属于___。
(2)中间体(Ⅰ)中画*号的碳原子的立体构型与下列化合物中画*号碳原子接近的是(_____)
A.*CH≡CH B.CH3*CH2CH3 C.![]() D.
D.![]()
(3)模仿上题,完成下列反应(不必写中间体,不考虑反应条件,但要求配平)。
①![]() +
+![]() →___
→___
②![]() (过量)+CHCl3 →___
(过量)+CHCl3 →___
③![]() + →
+ →![]() +HBr___
+HBr___
【答案】加成 消去 取代 B  +HCl
+HCl  +3HCl CH3CH2Br
+3HCl CH3CH2Br
【解析】
(1)中间体(Ⅰ)为橙色固体,熔点-15℃,它是由负离子BF4-与一个六元环的正离子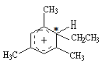 组成的,正离子中正电荷平均分配在除划*号碳原子以外的另五个成环的碳原子上,所以从反应类型看,反应A属于加成反应;
组成的,正离子中正电荷平均分配在除划*号碳原子以外的另五个成环的碳原子上,所以从反应类型看,反应A属于加成反应;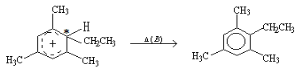 ,相当于消掉了1个小分子HBF4,反应B属于消去反应,全过程
,相当于消掉了1个小分子HBF4,反应B属于消去反应,全过程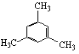
![]()
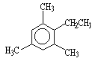 ,是乙基代替苯环上的1个H原子,所以属于取代反应。
,是乙基代替苯环上的1个H原子,所以属于取代反应。
(2)中间体(Ⅰ)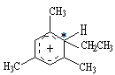 中画*号的碳原子是单键碳,为四面体结构,与CH3*CH2CH3画*号碳原子接近,选B。
中画*号的碳原子是单键碳,为四面体结构,与CH3*CH2CH3画*号碳原子接近,选B。
(3)①![]() +
+![]() 反应是
反应是![]() 中的1个氢原子被
中的1个氢原子被![]() 代替,反应方程式是
代替,反应方程式是![]() +
+![]() →
→![]() +HCl;
+HCl;
②![]() (过量)+CHCl3 反应是CHCl3中的3个氯原子被3个苯环代替,反应方程式是
(过量)+CHCl3 反应是CHCl3中的3个氯原子被3个苯环代替,反应方程式是![]() (过量)+ CHCl3→
(过量)+ CHCl3→ +3HCl;
+3HCl;
③根据取代反应的定义,![]() + CH3CH2Br→
+ CH3CH2Br→![]() +HBr。
+HBr。


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】现以0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7。溶液混合时的体积变化忽略不计)。
加入NaOH溶液的体积V/mL | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
剩余盐酸溶液的体积V/mL | 20.00 | 2.00 | 0.20 | 0.02 | 0.00 | / | / | / | / |
过量NaOH溶液的体积V/mL | / | / | / | / | / | 0.02 | 0.20 | 2.00 | 20.00 |
pH | 1.00 | 2.28 | 3.30 | __ | 7.00 | 9.70 | __ | 11.70 | 12.50 |
(1)请利用表的数据绘制滴定曲线_____。
(2)如果初读数和末读数如图所示,滴定液的用量为__mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化就是将煤转化为可燃气体的过程。水蒸气通过灼热的煤所产生的混和气,其主要成份是CO、H2还含有CO2和水蒸气。用下列装置检验混和气中部分物质,下列说法不正确的是( )
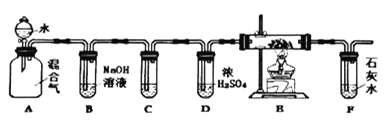
A.若A和B之间增加装无水CuSO4的干燥管可检验H2O的存在
B.若试管C和E中分别装澄清石灰水、CuO,可检验CO的存在
C.在装置F之后,应该放置一只燃着的酒精灯,防止CO污染空气
D.工业上将煤气化,其目的是获得洁净的燃料和化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是一种不稳定的物质,它的分子组成可用OXFY表示。10mLA气体能分解生成15mL O2和10mL F2(同温同压下)
(1)A的化学式是____________,推断时依据的定律是___________
(2)已知A分子中x个氧原子呈…-O-O-O-…链状排列,则A分子的电子式是_________结构式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)。
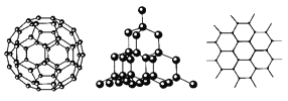
(1)C60、金刚石和石墨三者的关系互为________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)固态时,C60属于________晶体(填“离子”、“原子”或“分子”),C60分子中含有双键的数目是________个。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________个。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=﹣Q1kJmol﹣1
2H2(g)+O2(g)=2H2O(g)ΔH=﹣Q2kJmol﹣1,
2H2(g)+O2(g)=2H2O(l) ΔH2=﹣Q3kJmol﹣1
常温下,取体积比2∶3的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2B.0.2Q1+0.05Q2C.0.2Q1+0.15Q3D.0.2Q1+0.3Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2}是一种新型的起爆药。
(1)Ni能与CO形成配合物Ni(CO)4,配体CO中提供孤电子对的是C原子,其理由可能是__;该配合物分子中σ键与π键数目之比为__。
(2)①ClO4-的空间构型是___。
②写出与ClO4-互为等电子体的一种分子和一种离子:__、__。(填化学式)
(3)化学式中CHZ为碳酰肼,其结构为![]() ,它是一种新型的环保锅炉水除氧剂。
,它是一种新型的环保锅炉水除氧剂。
①碳酰肼中氮元素的化合价为__,碳原子的杂化轨道类型为__。
②碳酰肼可以由碳酸二甲酯(![]() )和肼(N2H4)反应制得,有关的化学方程式为__。
)和肼(N2H4)反应制得,有关的化学方程式为__。
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。
①比较次氯酸和高氯酸的酸性,并说明理由:___。
②如图为NiO晶胞,若晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个Ni2+距离最近的Ni2+数目为c,则a:b:c=__。
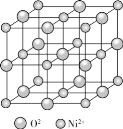
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成份为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如图:
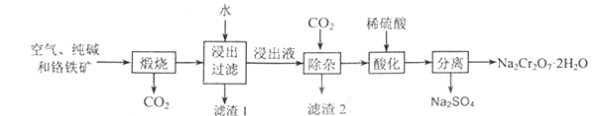
(1)煅烧过程中,铬铁矿中的Al2O3与纯碱反应的化学方程式为:____。
(2)滤渣1的成分为_____,滤渣2的成分为_____。
(3)该工艺中某种产物可以再利用,该物质的化学式为:_____。
(4)酸化时发生的反应为:2CrO42-+2H+![]() Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有
Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有![]() 转化为Cr2O72-。
转化为Cr2O72-。
①酸化时发生反应的平衡常数的表达式为K=_____。
②酸化后所得溶液中c(Cr2O72-)=____。
(3)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于____mol·L-1,后续废水处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。写出酸性条件下CrO42-与绿矾反应的离子方程式____。
Cr(OH)3。写出酸性条件下CrO42-与绿矾反应的离子方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在不同情况下的反应速率,其中的反应速率最快的是
2C(g)+2D(g)在不同情况下的反应速率,其中的反应速率最快的是
A. v(A)=0.20 mol/(L·s) B. v(B)=0.30 mol/(L·s)
C. v(C)=0.50 mol/(L·s) D. v(D)=0.60 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com