
【题目】乙炔(C2H2)气体的燃烧热为ΔH=-1299.6kJ·mol-1,分别写出表示乙炔燃烧反应的热化学方程式和表示乙炔燃烧热的热化学方程式____、____。
【答案】2C2H2(g)+ 5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599.2kJ·mol-1 C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6kJ·mol-1
【解析】
乙炔的燃烧热(△H)为-1299.6kJ/mol,则1molC2H2(g)完全燃烧生成水和二氧化碳放出1366.8KJ的热量。
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-QkJ·mol-1,由(C2H2)燃烧热为ΔH=-1299.6 kJ·mol-1知Q=2599.2。表示燃烧反应的热化学方程式为2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599.2 kJ·mol-1。表示燃烧热的热化学方程式中可燃物的化学计量数必为1,则表示燃烧热的热化学方程式为C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6 kJ·mol-1,
O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6 kJ·mol-1,
故答案为:2C2H2(g)+ 5O2(g)=4CO2(g)+2H2O(l)ΔH=-2599.2kJ·mol-1;C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6kJ·mol-1。
O2(g)=2CO2(g)+H2O(l) ΔH=-1299.6kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用![]() (熔点2045℃)和冰晶石(
(熔点2045℃)和冰晶石(![]() )混合熔融后电解制得。请回答下列问题:
)混合熔融后电解制得。请回答下列问题:
(1)铝属于活泼金属却能在空气中稳定存在,其原因是__________,冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,请写出铝与V2O5在高温下反应的化学方程式:___________。
(2)将![]() 液和
液和![]() 溶液混合制取
溶液混合制取![]() 。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
(3)下列关于铝元素的叙述不正确的是__________(填序号)。
A.铝是人类最早使用的金属
B.镁铝合金既可完全溶于过量的盐酸,又可完全溶于过量的NaOH溶液
C.氢氧化铝是一种两性氢氧化物,既能溶于盐酸又能溶于NaOH溶液
D.铝是人体必需的微量元素之一,因此在生活中人们应尽量使用铝制炊具和餐具更有利于身体健康
(4)某工厂排放出有毒物质NOCl,它遇水就会生成![]() 。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的
。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的![]() 对人类健康会产生危害,为了降低水源中
对人类健康会产生危害,为了降低水源中![]() 的浓度,有研究人员建议在碱性条件下用铝粉将
的浓度,有研究人员建议在碱性条件下用铝粉将![]() 还原为N2,此时铝主要以
还原为N2,此时铝主要以![]() 的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的
的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的![]() 在标况下的体积约为_______L。
在标况下的体积约为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7。溶液混合时的体积变化忽略不计)。
加入NaOH溶液的体积V/mL | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
剩余盐酸溶液的体积V/mL | 20.00 | 2.00 | 0.20 | 0.02 | 0.00 | / | / | / | / |
过量NaOH溶液的体积V/mL | / | / | / | / | / | 0.02 | 0.20 | 2.00 | 20.00 |
pH | 1.00 | 2.28 | 3.30 | __ | 7.00 | 9.70 | __ | 11.70 | 12.50 |
(1)请利用表的数据绘制滴定曲线_____。
(2)如果初读数和末读数如图所示,滴定液的用量为__mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)与氢气或与水在催化剂作用下的反应如下:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=-17kJ/mol;
H2S(g)+CO(g) △H1=-17kJ/mol;
Ⅱ.COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2=-35kJ/mol。
H2S(g)+CO2(g) △H2=-35kJ/mol。
回答下列问题:
(1)两个反应在热力学上趋势均不大,其原因是:________________。
(2)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的△H=_______。
H2(g)+CO2(g)的△H=_______。
(3)羰基硫、氢气、水蒸气共混体系初始投料比不变,提高羰基硫与水蒸气反应的选择性的关键因素是______。
(4)在充有催化剂的恒压密闭容器中只进行反应Ⅰ![]() 设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:
设起始充入的n(H2):n(COS)=m,相同时间内测得COS转化率与m和温度(T)的关系如图所示:

①m1______m2(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
②温度高于T0,COS转化率减小的可能原因为:i有副应发生;ii______;iii______。
(5)在充有催化剂的恒压密闭容器中进行反应Ⅱ.COS(g)与H2O(g)投料比分别为1:3和1:1,反应物的总物质的量相同时,COS(g)的平衡转化率与温度的关系曲线如图所示:
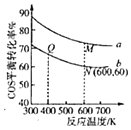
①M点对应的平衡常数______Q点![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;
;
②N点对应的平衡混合气中COS(g)物质的量分数为______;
③M点和Q点对应的平衡混合气体的总物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:_________________。
(2)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______________________。
(3)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应如6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
已知:2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,则O3转化为O2的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化就是将煤转化为可燃气体的过程。水蒸气通过灼热的煤所产生的混和气,其主要成份是CO、H2还含有CO2和水蒸气。用下列装置检验混和气中部分物质,下列说法不正确的是( )
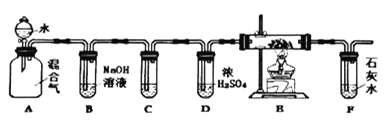
A.若A和B之间增加装无水CuSO4的干燥管可检验H2O的存在
B.若试管C和E中分别装澄清石灰水、CuO,可检验CO的存在
C.在装置F之后,应该放置一只燃着的酒精灯,防止CO污染空气
D.工业上将煤气化,其目的是获得洁净的燃料和化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是一种不稳定的物质,它的分子组成可用OXFY表示。10mLA气体能分解生成15mL O2和10mL F2(同温同压下)
(1)A的化学式是____________,推断时依据的定律是___________
(2)已知A分子中x个氧原子呈…-O-O-O-…链状排列,则A分子的电子式是_________结构式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成份为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如图:
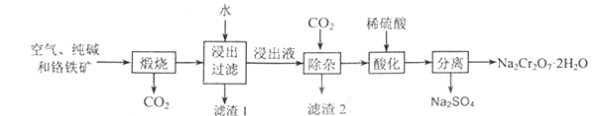
(1)煅烧过程中,铬铁矿中的Al2O3与纯碱反应的化学方程式为:____。
(2)滤渣1的成分为_____,滤渣2的成分为_____。
(3)该工艺中某种产物可以再利用,该物质的化学式为:_____。
(4)酸化时发生的反应为:2CrO42-+2H+![]() Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有
Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有![]() 转化为Cr2O72-。
转化为Cr2O72-。
①酸化时发生反应的平衡常数的表达式为K=_____。
②酸化后所得溶液中c(Cr2O72-)=____。
(3)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于____mol·L-1,后续废水处理方能达到国家排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。写出酸性条件下CrO42-与绿矾反应的离子方程式____。
Cr(OH)3。写出酸性条件下CrO42-与绿矾反应的离子方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com