
【题目】NA为阿伏加德罗常数,下列说法错误的是 ( )
A.28克氮气所含的原子数目为2NA;
B.在标况下,0.5NA氯分子所占体积约是11.2L;
C.只有在标况下NA氧气分子的物质的量才是1mol;
D.在70℃、1×105Pa下,46克NO2与标况下46克四氧化二氮均含有3NA原子。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,气体密度不变
④恒温恒压时,充入惰性气体,平衡不移动
⑤加入催化剂,B的平衡转化率提高
A.①②B.②C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用![]() (熔点2045℃)和冰晶石(
(熔点2045℃)和冰晶石(![]() )混合熔融后电解制得。请回答下列问题:
)混合熔融后电解制得。请回答下列问题:
(1)铝属于活泼金属却能在空气中稳定存在,其原因是__________,冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,请写出铝与V2O5在高温下反应的化学方程式:___________。
(2)将![]() 液和
液和![]() 溶液混合制取
溶液混合制取![]() 。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
。该实验用于盛装NaF溶液的试剂瓶_________(填“能”或“不能”)用玻璃瓶,原因是_______。
(3)下列关于铝元素的叙述不正确的是__________(填序号)。
A.铝是人类最早使用的金属
B.镁铝合金既可完全溶于过量的盐酸,又可完全溶于过量的NaOH溶液
C.氢氧化铝是一种两性氢氧化物,既能溶于盐酸又能溶于NaOH溶液
D.铝是人体必需的微量元素之一,因此在生活中人们应尽量使用铝制炊具和餐具更有利于身体健康
(4)某工厂排放出有毒物质NOCl,它遇水就会生成![]() 。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的
。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________,水源中的![]() 对人类健康会产生危害,为了降低水源中
对人类健康会产生危害,为了降低水源中![]() 的浓度,有研究人员建议在碱性条件下用铝粉将
的浓度,有研究人员建议在碱性条件下用铝粉将![]() 还原为N2,此时铝主要以
还原为N2,此时铝主要以![]() 的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的
的形式存在于溶液中,请写出该反应的离子方程式:__________,当该反应转移5mol电子时,产生的![]() 在标况下的体积约为_______L。
在标况下的体积约为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1) N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为______。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH-=2NO2-+H2O;2NO2+2OH-=NO3-+NO2-+H2O;
①下列措施能提高尾气中NO和NO2去除率的有______(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是______(填化学式);吸收后排放的尾气中含量较高的氮氧化物是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是 ( )
A.pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合,混合后溶液pH=7
B.碳酸钠溶液中:2c(Na+) =c(CO32-)+c(HCO3-) +c(H2CO3)
C.将0.1 mol·L-1的氢氧化钠溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7
D.pH相同的醋酸钠溶液、苯酚钠溶液、碳酸钠溶液、氢氧化钠溶液c(CH3COONa)>c(Na2CO3) >c(C6H5ONa ) >c(NaOH )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A.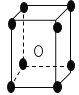 B.
B.
C.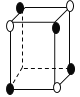 D.
D.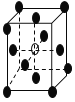
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7。溶液混合时的体积变化忽略不计)。
加入NaOH溶液的体积V/mL | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
剩余盐酸溶液的体积V/mL | 20.00 | 2.00 | 0.20 | 0.02 | 0.00 | / | / | / | / |
过量NaOH溶液的体积V/mL | / | / | / | / | / | 0.02 | 0.20 | 2.00 | 20.00 |
pH | 1.00 | 2.28 | 3.30 | __ | 7.00 | 9.70 | __ | 11.70 | 12.50 |
(1)请利用表的数据绘制滴定曲线_____。
(2)如果初读数和末读数如图所示,滴定液的用量为__mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是一种不稳定的物质,它的分子组成可用OXFY表示。10mLA气体能分解生成15mL O2和10mL F2(同温同压下)
(1)A的化学式是____________,推断时依据的定律是___________
(2)已知A分子中x个氧原子呈…-O-O-O-…链状排列,则A分子的电子式是_________结构式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com