
【题目】人造羊毛的主要成分为![]() ,此物质可由以下三种途径合成,已知A是石油分馏的一种产品,A均裂可生成等物质的量的C2H4和C2H6。
,此物质可由以下三种途径合成,已知A是石油分馏的一种产品,A均裂可生成等物质的量的C2H4和C2H6。
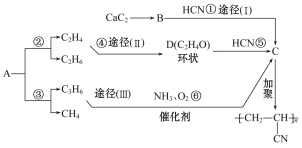
回答下列问题:
(1)写出A的分子式______,D的结构式______。
(2)在反应①~⑥中,属于加成反应的是________。
(3)写出反应⑥的化学反应方程式:____________。
(4)从能源和环保的角度看,你认为最有发展前景的是_____,其中的理由是______。
【答案】C4H10 ![]() ①④ 2CH2
①④ 2CH2![]() CH—CH3+2NH3+3O2
CH—CH3+2NH3+3O2![]() 2CH2
2CH2![]() CH—CN+6H2O 途径(Ⅲ) ①原料来源丰富;②生产过程能耗低,产品产率高;③生产过程污染少
CH—CN+6H2O 途径(Ⅲ) ①原料来源丰富;②生产过程能耗低,产品产率高;③生产过程污染少
【解析】
根据人造羊毛的结构简式,推出C的结构简式为CH2=CHCN,根据合成路线,A均裂可生成等物质的量的C2H4和C2H6,利用原子守恒,推出A的分子式为C4H10,CaC2生成B,则B为乙炔,D为环状,其分子式为C2H4O,即D为环氧乙烷,结构简式为![]() ,然后在进行分析;
,然后在进行分析;
根据人造羊毛的结构简式,推出C的结构简式为CH2=CHCN,根据合成路线,A均裂可生成等物质的量的C2H4和C2H6,利用原子守恒,推出A的分子式为C4H10,CaC2生成B,则B为乙炔,D为环状,其分子式为C2H4O,即D为环氧乙烷,结构简式为![]() ,
,
(1)由反应②③逆推,可知A的分子式为C4H10;D的分子式为C2H4O,其结构为环状,只能是环氧乙烷,其结构简式为![]() ;
;
(2)由![]() 逆推得C:CH2
逆推得C:CH2![]() CH—CN,B为HC≡CH,①为加成反应;④反应为:CH2
CH—CN,B为HC≡CH,①为加成反应;④反应为:CH2![]() CH2
CH2![]()
![]() 该反应符合加成反应的概念[有机分子是双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应],也是加成反应;⑤反应是取代反应:
该反应符合加成反应的概念[有机分子是双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应],也是加成反应;⑤反应是取代反应:![]() +H—CN
+H—CN![]() CH2
CH2![]() CH—CN+H2O;⑥反应也是取代反应:CH2
CH—CN+H2O;⑥反应也是取代反应:CH2![]() CH—CH3
CH—CH3![]() CH2
CH2![]() CH—CN;符合条件的是①④;
CH—CN;符合条件的是①④;
(3)⑥反应的结果是1个氮原子代替了3个氢原子,氮原子可由NH3提供,这样游离的6个氢原子将被![]() 个O2分子接受。据此,可写出⑥的反应方程式2CH2
个O2分子接受。据此,可写出⑥的反应方程式2CH2![]() CH—CH3+2NH3+3O2
CH—CH3+2NH3+3O2![]() 2CH2
2CH2![]() CH—CN+6H2O;
CH—CN+6H2O;
(4)从环保角度看,途径(Ⅰ)(Ⅱ)都使用了HCN,HCN有毒,对环境有危害,其发展前景不及途径(Ⅲ),从能源角度看,途径(Ⅰ)使用了CaC2,而合成CaC2需要耗费大量的电能,其发展前景不及途径(Ⅱ)和(Ⅲ);途径(Ⅱ)( Ⅲ)相比,途径(Ⅱ)反应环节多,需要设备多,途径(Ⅲ)使用了催化剂,耗能少,故途径(Ⅱ)的发展前景又不及途径(Ⅲ)。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】(10分)化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
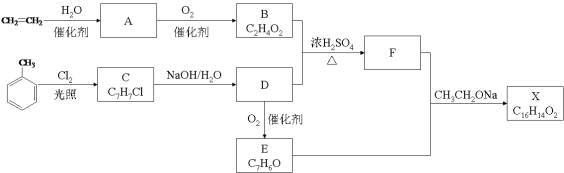
已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’
RCH=CHCOOR’
请回答:
(1)E中官能团的名称是 。
(2)B+D→F的化学方程式 。
(3)X的结构简式 。
(4)对于化合物X,下列说法正确的是 。
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用如图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
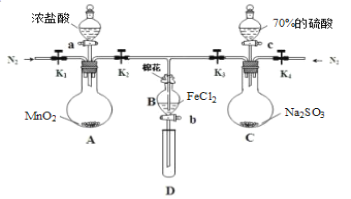
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_____________。
(2)棉花中浸润的溶液为________________,作用是____________ 。
(3)导致步骤Ⅲ中溶液变黄的离子反应是__________,用________(写试剂化学式)检验氧化产物,现象是____________。
(4)能说明氧化性Fe3+>SO2的离子方程式是___________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有 |
乙 | 既有Fe3+又有Fe2+ | 有 |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为只含有C、H、O三种元素的芳香烃衍生物,且苯环上只有两个取代基。各物质间的相互转化关系如下图所示。

已知:D通过加聚反应得到 E,E分子式为(C9H8O2)n;H分子式为C18H16O6;I中除含有一个苯环外还含有一个六元环。
(1)写出A的分子式:A______________。
(2)写出I、E的结构简式:I______________ E_________________;
(3)A+G→H的反应类型为____________________________;
(4)写出A→F的化学方程式__________________________。
(5)有机物A的同分异构体只有两个对位取代基,既能与Fe3+发生显色反应,又能发生水解反应,但不能发生银镜反应。则此类A的同分异构体有_______种,其中一种在NaOH溶液中加热消耗的NaOH最多。写出该同分异构体与NaOH溶液加热反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下反应中的四种物质由三种元素组成,其中a的分子立体构型为正四面体形,组成a物质的两种元素的原子序数之和小于10,组成b物质的元素为第三周期元素。下列判断正确的是
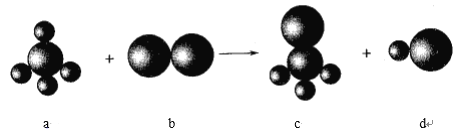
A. 四种分子中的化学键均是极性键
B. a、c分子中中心原子均采用sp3杂化
C. 四种分子中既有σ键,又有π键
D. b、d分子中共价键的键能:b>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
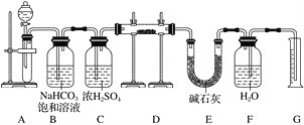
回答下列问题:
(1)装置A中液体试剂选用________________。
(2)装置B的作用是_________。装置E中碱石灰的作用是________。
(3)装置D中发生反应的化学方程式是__________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL 0.1molL-1 NaOH溶液中逐滴加入0.2molL-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )

A. B点,a=12.5
B. D点,c(Na+)=c(CH3COO-)+c(CH3COOH)
C. 在C点升温,CH3COOH电离程度增大,CH3COO-的水解程度减小
D. 在A、B间存在一点,此点水的电离程度最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com