
【题目】游离态的氮经一系列转化可以得到硝酸,如下图所示。

(1)NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)NO2→HNO3反应中氧化剂和还原剂的物质的量之比为________________。
(3)2NO(g)+O2(g) ![]() 2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一。在800℃时,向容积为1L的密闭容器中充入0.010molNO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。

①2min内,v(O2)=________mol/(L·min)
②800℃时,该反应的化学平衡常数为__________。
③判断该反应达到平衡的依据是(写出2条即可)____________。
④已知:ⅰ.
ⅱ.N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ·mol-1,写出NO生成NO2热化学方程式_____________,温度对于NO生成NO2平衡转化率的影响是:___________________。
(4)电解法处理含氮氧化物废气,可以回收硝酸。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极)。请写出电极过程中NO转化为硝酸的电极反应式:______________。

【答案】 4NH3 + 5O2 ![]() 4NO + 6H2O 1:2 1.25×10-3 400 体系压强不变、各物质浓度不变、各物质体积分数不变等等。 2NO(g)+O2(g)
4NO + 6H2O 1:2 1.25×10-3 400 体系压强不变、各物质浓度不变、各物质体积分数不变等等。 2NO(g)+O2(g) ![]() 2NO2(g) ΔH = -115 kJ·mol-1。 温度升高,平衡向逆反应方向移动,NO转化为NO2的平衡转化率降低 NO-3e- + 2H2O === NO3- + 4H+
2NO2(g) ΔH = -115 kJ·mol-1。 温度升高,平衡向逆反应方向移动,NO转化为NO2的平衡转化率降低 NO-3e- + 2H2O === NO3- + 4H+
【解析】(1)NH3和O2在催化剂作用下反应生成一氧化氮和水,反应的化学方程式为4NH3 + 5O2 ![]() 4NO + 6H2O;(2)NO2溶于水生成硝酸和NO:3NO2+H2O=2HNO3+NO,其中NO是还原产物,硝酸是氧化产物,则反应中氧化剂和还原剂的物质的量之比为1:2;(3)①由图象可知用NO浓度的变化计算反应速率 v(NO)=(0.010mol/L0.005mol/L)/2min=0.025mol/(Lmin),则v(O2)=1/2v(NO)=1.25×10-3mol/(Lmin);②
4NO + 6H2O;(2)NO2溶于水生成硝酸和NO:3NO2+H2O=2HNO3+NO,其中NO是还原产物,硝酸是氧化产物,则反应中氧化剂和还原剂的物质的量之比为1:2;(3)①由图象可知用NO浓度的变化计算反应速率 v(NO)=(0.010mol/L0.005mol/L)/2min=0.025mol/(Lmin),则v(O2)=1/2v(NO)=1.25×10-3mol/(Lmin);②
2NO(g)+O2(g)2NO2(g)
起始浓度(mol/L) 0.01 0.005 0
平衡浓度(mol/L) 0.005 0.0025 0.005
则k=c2(NO2)/c2(NO)·c(O2)=0.0052/0.0052×0.0025=400;
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。该反应是体积减小的可逆反应,所以判断该反应达到平衡的依据有:体系压强不变、各物质浓度不变、各物质体积分数不变等。④i.N2(g)+O2(g)=2NO(g)△H=(945kJ/mol+498kJ/mol)-2×630kJ/mol=+183kJ/mol,ii.N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,则盖斯定律ii-i得到2NO(g)+O2(g)=2NO2(g)△H=-115 kJ/mol。温度升高,平衡向逆反应方向移动,NO转化为NO2的平衡转化率降低;(4)电解过程中NO在阳极失去电子转化为硝酸的电极反应式为NO-3e- +2H2O=NO3- + 4H+。


科目:高中化学 来源: 题型:
【题目】氯的含氧酸根离子有 ClO-、 ClO2- 、 ClO3-、 ClO4- 等,关于它们的说法不正确的是( )
A. ClO4-是 sp3 杂化 B. ClO3- 的空间构型为三角锥形
C. ClO2-的空间构型为直线形 D. ClO- 中 Cl 显+1 价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于吸热反应是
A. 金属钠与水的反应 B. 盐酸与氢氧化钠的反应
C. 铝与氧化铁的铝热反应 D. NH4Cl晶体与Ba(OH)2·8H2O晶体反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。

(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2) I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3 )第二步中让 _____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):

(5 )请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
方法三:(7)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来表示):__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙连个探究性学习小组,他们拟测定过氧化钠样品(含少量的Na2O)的纯度。
(1)甲组同学拟选用图l实验装置完成实验:

①写出实验中所发生主要反应的化学方程式____________
②该组同学必须选用的装置的连接顺序是:
A 接(____),(____)接(____), (____)接(____) (填接口字母,可不填满);
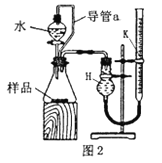
(2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了图2所示的实验装置。
①装置中导管a的作用:__________
②实验结束冷却至室温后,在读取量气管k中液面读数时,K中液面高于H中的液面,则测量结果将__________(偏高,不变或偏低),若有影响,应进行_________(操作)后再读效;
③若实验中样品的质量为mg,实验前后量气管k中液面读数分别为V0L、V1L(V0> V1换算成标况)。则样品的纯度为__________(含m、V0、V1的表达式)
(3)图2的装置可测定一定质量铜铁合金(不含其它元素)样品中铁的质量分数。分液漏斗中加入的试剂是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1mol任何物质的体积都约是22.4L
B.1molH2所占的体积约是22.4L
C.1molH2和1mol H2O所含的分子数相同
D.16gN2和16gO2所含的分子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:

(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】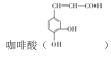 是制备某种抗肿瘤药物的重要原料。由甲苯制备咖啡酸的合成路线(部分反应条件略去)如图所示:
是制备某种抗肿瘤药物的重要原料。由甲苯制备咖啡酸的合成路线(部分反应条件略去)如图所示:

已知:
(1)咖啡酸的分子式为_____,含氧官能团有______。
(2)A的结构简式为_____,该分子的核磁共振氢谱峰面积之比为______。
(3)反应④的化学方程式为________,反应类型为_______。
(4)满足下列条件的咖啡酸的同分异构体有_____种。
①苯环上有三个取代基②1mol该物质能与2molNaHCO3反应。
(5)检验F中碳碳双键官能团的方法是_______。
(6)苯丙烯酸的结构简式为![]() ,根据提供信息ii,设计以甲苯和乙醛为原料制备苯丙烯酸的合成路线。_______
,根据提供信息ii,设计以甲苯和乙醛为原料制备苯丙烯酸的合成路线。_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com