
【题目】一定条件下硝铵受热分解的化学方程式为5NH4NO3![]() 2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子个数之比为:
2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子个数之比为:
A. 5:4 B. 5:3 C. 1:1 D. 3:5
【答案】B
【解析】试题分析:在5NH4NO3=2HNO3+4N2+9H2O的反应中,NH4+→N2,N元素的化合价由-3价→0价,-3价的N元素被氧化,化合价升高3价,NO3-→N2,N元素的化合价由+5价→0价,+5价的N元素化合价降低,被还原,化合价降低5价,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等可知,发生还原反应与发生氧化反应的氮原子数之比是3:5,故选D。
【名师点晴】本题考查氧化还原反应的计算。氧化还原反应的特征是有化合价的升降,可从化合价变化的角度分析氧化还原反应,反应中,化合价的变化可在同一种元素之间,也可在不同元素的之间,氧化剂得电子被还原,化合价降低,还原剂失电子被氧化,化合价升高。本题注意根据方程式判断元素的化合价的变化,判断N元素化合价的变化为解答该题的关键。


科目:高中化学 来源: 题型:
【题目】有关下列图像的分析正确的是
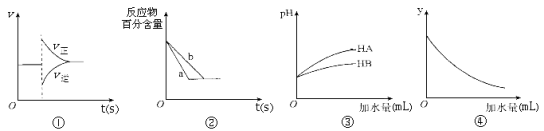
A.图①表示在N2(g)+3H2(g)![]() 2NH3(g)达到平衡后,减少NH3浓度时速率的变化
2NH3(g)达到平衡后,减少NH3浓度时速率的变化
B.图②中a、b曲线分别表示反应H2(g)十I2(g)![]() 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
C.图③说明HA是比HB更弱的酸
D.图④中的y可表示将冰醋酸加水稀释时溶液导电能力的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )

A. 还原剂是含CN-的物质,氧化产物不只有N2
B. 氧化剂是ClO-,还原产物是HCO3-
C. 参与反应的氧化剂与还原剂的物质的量之比为5:2
D. 标准状况下若生成2.24LN2则转移电子为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂,又不是还原剂的是
A.2Na+2H2O=2NaOH+H2↑ B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2 D.3Fe+4H2O![]() Fe3O4+4H2↑
Fe3O4+4H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在50mL18mol·L-1的浓H2SO4中加入足量的Cu片并加热,充分反应后,被还原的H2SO4的物质的量为
A.等于0.9mol
B.等于0.45mol
C.大于0.45mol,小于0.9mol
D.小于0.45mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
(1)Ba(OH)2:_______________________________________。
(2)KHSO4:________________________________________。
(3)HNO3:_________________________________________。
(4)Na2CO3:_______________________________________。
(5)NaHCO3:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中:氧化性IO3—>I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是( )
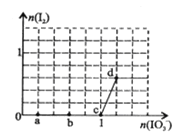
A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+2IO3- =I2+5SO42-+3H++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com