
【题目】煤的气化和液化是现代能源工业中重点考虑的综合利用技术。最常见的气化方法是用煤作原料生产水煤气,而比较流行的液化方法是煤在催化剂等条件下生产CH3OH。
已知制备甲醇的有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-90.8 kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g)△H2=-412 kJmol-1
③CO(g)+2H2(g)CH3OH(g)△H3
I.回答下列问题:
(1)欲提高甲醇的产率,可以采取的措施有______(填字母序号)。
A.升高温度
B.增大压强
C.降低温度
D.降低压强
(2)提高甲醇反应选择性的关键因素是______。
(3)保持温度和容积不变,下列描述能说明反应③达到平衡状态的是______(填字母序号)。
A.v(CO):v(H2):v(CH3OH)=1:2:1
B.混合气体的压强不再随时间的变化而变化
C.单位时间内断裂2 mol H-H键,同时生成3mol C-H键
D.一段时间内的平均反应速率等于0
E.混合气体的平均摩尔质量保持不变
Ⅱ.在一密闭容器中投入1mol CO和2molH2发生反应③,实验测得平衡时甲醇的物质的量随温度、压强变化关系如图1所示:

(1)压强P1______P2(填“>”、“<“或”=”)。
(2)M、N两点的化学反应速率:vM______vN(填“>”、“<“或“=”)
(3)对于气相反应,用某组分B的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数(Kp),则M点时,平衡常数Kp=______(P1=5 MPa)。
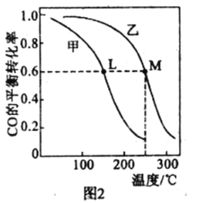
(4)甲、乙两个恒容密闭容器的体积相同,向甲中加入 1molCO和 2mol H2,向乙中加入2mol CO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)______2P(L),平衡常数:K(M)______K(L)(填“>”、“>”或“=”)。
【答案】BC 合适的催化剂 BDE > > ![]() > <
> <
【解析】
I.(1)首先根据盖斯定律,写出CO(g)+2H2(g)=CH3OH(g)的热化学反应方程式,然后根据勒夏特列原理进行分析;
(2)提高甲醇反应选择性的关键因素是合适的催化剂;
(3)根据化学平衡状态的定义进行分析;
II.(1)作等温线,增大压强,平衡向正反应方向进行,CH3OH的物质的量增大,据此分析;
(2)利用压强对反应速率的影响进行分析;
(3)利用“三段式”法进行计算;
(4)平衡常数只受温度的影响,正反应为放热反应,温度越高,化学平衡常数越小;
I.(1)根据目标反应方程式,以及盖斯定律,①+②得出△H3=(-90.8kJ·mol-1-412kJ·mol-1)=-502.8kJ·mol-1,
A.该反应为放热反应,升高温度,平衡向逆反应方向进行,甲醇的产率降低,故A不符合题意;
B.根据反应方程式,增大压强,平衡向正反应方向进行,甲醇物质的量增大,即产率增大,故B符合题意;
C.该反应为放热反应,降低温度,平衡向正反应方向进行,甲醇物质的量增大,即产率增大,故C符合题意;
D.降低压强,平衡向逆反应方向进行,甲醇物质的量减少,产率降低,故D不符合题意;
故答案选BC;
(2)提高甲醇反应选择性的关键因素是选择合适的催化剂;
(3) A.没有指明反应的方向,因此无法判断是否达到平衡,故A不符合题意;
B.恒温恒容下,反应前后气体系数之和不相等,因此当压强不再改变,说明反应达到平衡,故B符合题意;
C.断裂H-H键和生成C-H键,反应都是向正反应方向进行,因此单位时间内断裂2molH-H键,同时生成3molC-H键,不能说明反应达到平衡,故C不符合题意;
D.当达到平衡时,同种物质消耗量和生成量相等,即一段时间内的平均反应速率等于0,故D符合题意;
E.根据![]() ,组分都是气体,所以气体质量不变,反应前后气体系数之和不相等,因此当平均摩尔质量不变时,说明反应达到平衡,故E符合题意;
,组分都是气体,所以气体质量不变,反应前后气体系数之和不相等,因此当平均摩尔质量不变时,说明反应达到平衡,故E符合题意;
故答案选BDE;
II.(1)根据反应方程式,增大压强,平衡向正反应方向移动,CH3OH物质的量增多,根据图像,作等温线,P1对应甲醇的物质的量大于P2时的,因此P1>P2;
(2)M、N两点温度相等,M点的压强大于N点压强,压强越大,反应速率越快,v(M)>v(N);
(3)利用“三段式”进行分析,M点CH3OH物质的量为0.25mol,因此有 平衡常数Kp=
平衡常数Kp= =
=![]() ;
;
(4)M点和L点,CO的转化率相同,因为体积相同,且乙中气体是甲中气体的2倍,则相同温度是P(M)=2P(L),M点温度高,因此P(M)>2P(L);平衡常数只与温度有关,该反应为放热反应,温度越高反应进行的限度越小,平衡常数越小,因此K(M)<K(L)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】刚结束的两会《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种正负电极反应均涉及氢气的新型“全氢电池”,能量效率可达80%。下列说法中错误的是

A. 该装置将化学能转换为电能
B. 离子交换膜允许H+和OH-通过
C. 负极为A,其电极反应式是H2-2e- + 2OH- = 2H2O
D. 电池的总反应为H+ + OH-![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态溴原子的价层电子轨道排布图为________。
(2)第四周期中,与溴原子未成对电子数相同的金属元素有________种。
(3)某同学画出基态碳原子的核外电子排布图为![]() ,该电子排布图违背了________。
,该电子排布图违背了________。
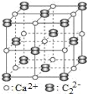
(4)CaC2 中C22-与O22+互为等电子体。
①O22+的电子式可表示为______。
②CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图所示),但CaC2晶体中含有哑铃形C22-的存在,使晶胞沿一个方向拉长。则CaC2晶体中1个Ca2+周围距离最近的C22-数目为_____。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
①磷化硼晶体晶胞如图甲所示:己知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度(g/cm3)为________(写出计算式即可)。
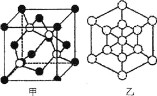
②图甲中![]() 表示P原子,在图乙(磷化硼晶胞沿着体对角线方向的投影)中用
表示P原子,在图乙(磷化硼晶胞沿着体对角线方向的投影)中用![]() 画出P原子的投影位置。__________________________
画出P原子的投影位置。__________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明醋酸是弱电解质,下列方法不正确的是( )
A.比较相同物质的量浓度的NaOH溶液和醋酸溶液恰好反应完全时消耗两溶液的体积
B.将1mLpH=3的醋酸溶液稀释到100mL,测其pH小于5
C.比较浓度均为0.1mol·L-1盐酸和醋酸溶液的导电能力
D.测定0.1mol·L-1醋酸溶液的PH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是( )
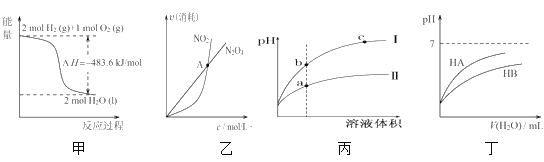
A.由甲可知:热化学方程式是H2(g)+![]() O2(g)=H2O(g)
O2(g)=H2O(g) ![]() H=-241.8kJ/mol
H=-241.8kJ/mol
B.由乙可知:对于恒温恒容条件下的反应2NO2(g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.由丙可知:相同pH的盐酸和醋酸溶液分别加水稀释,b点溶液的导电性比c点溶液的导电性强
D.由丁可知:同温度、同物质的量浓度的HA溶液与HB溶液相比,其pH前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

ΔH=88.6 kJ/mol则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热为-726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_______________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
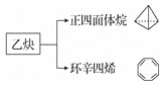
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过____方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
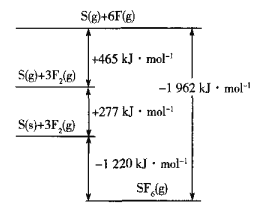
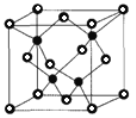
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO2加压后颜色先变深后变浅 ⑤加入催化剂有利于合成氨的反应 ⑥由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧B. ①③⑤⑦C. ②⑤⑥⑦D. ②③⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com