
【题目】根据所学电化学知识,回答下列问题:

(1)①甲池中通入CH3OH的电极名称是________极,写出其电极反应式_______;乙池中石墨电极反应式为_______;丙池中反应的离子方程式为_______;
②反应一段时间后,甲池中消耗560mL(标准状况下)O2,此时乙池溶液的pH=_______;若向乙池中加入_______,其质量为_______g,能使CuSO4溶液恢复到原浓度(假设电解前后溶液的体积不变,均为100mL)。丙池中理论上最多产生_______g固体。
(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,写出此过程中阴极上的电极反应式____________________________。
【答案】负极 CH3OH-6e-+8OH-=CO32-+6H2O 4OH--4e-=O2↑+2H2O Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑ pH=0 CuO 4g 2.9g Cu2++e-+Cl=CuCl
Mg(OH)2↓+H2↑+Cl2↑ pH=0 CuO 4g 2.9g Cu2++e-+Cl=CuCl
【解析】
(1)①燃料电池中可燃物作为负极材料失去电子,CH3OH发生氧化反应,所以该电极是负极,反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;乙池为以甲池为外加电源的电解池,石墨电极连接正极,为阳极氢氧根离子放电,电极反应式为:4OH--4e-=O2↑+2H2O;丙池为惰性电极电解氯化镁溶液,反应的离子方程式为:Mg2++2Cl-+2H2O![]() Mg(OH)2↓+H2↑+Cl2↑;②反应一段时间后,甲池中消耗560mL(标准状况下)O2,为
Mg(OH)2↓+H2↑+Cl2↑;②反应一段时间后,甲池中消耗560mL(标准状况下)O2,为![]() =0.025mol,根据反应O2+4e-+2H2O =4OH-,则转移电子的物质的量为0.025mol×4=0.1mol,根据乙池是电极反应4OH--4e-=O2↑+2H2O,则溶液中产生氢离子的物质的量为0.1mol,浓度为
=0.025mol,根据反应O2+4e-+2H2O =4OH-,则转移电子的物质的量为0.025mol×4=0.1mol,根据乙池是电极反应4OH--4e-=O2↑+2H2O,则溶液中产生氢离子的物质的量为0.1mol,浓度为![]() =1mol/L,则pH=0;乙池中总反应式为2CuSO4+2H2O
=1mol/L,则pH=0;乙池中总反应式为2CuSO4+2H2O ![]() 2Cu+2H2SO4+O2↑,若向乙池中加入CuO,物质的量为氧气的2倍,其质量为2×0.025mol×80g/mol=4g,能使CuSO4溶液恢复到原浓度;根据丙装置中,在阳极上是氢离子放电,所以镁离子和氢氧根离子之间反应生成氢氧化镁,理论上最多产生氢氧化镁0.1mol×58g/mol=2.9g固体;(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,过程中铜离子得电子产生CuCl,阴极上的电极反应式为:Cu2++e-+Cl-=CuCl。
2Cu+2H2SO4+O2↑,若向乙池中加入CuO,物质的量为氧气的2倍,其质量为2×0.025mol×80g/mol=4g,能使CuSO4溶液恢复到原浓度;根据丙装置中,在阳极上是氢离子放电,所以镁离子和氢氧根离子之间反应生成氢氧化镁,理论上最多产生氢氧化镁0.1mol×58g/mol=2.9g固体;(2)工业上以石墨为电极,电解CuCl2溶液时,发现阴极上也会有CuCl析出,过程中铜离子得电子产生CuCl,阴极上的电极反应式为:Cu2++e-+Cl-=CuCl。


科目:高中化学 来源: 题型:
【题目】(1)不能用手直接拿取金属钠,其理由是:___________________;
(2)资料显示,钠着火时不能CO2灭火,为寻找原因进行如下探究实验:A、将燃烧匙中的钠引燃后迅速伸入盛有CO2的集气瓶中。可以看到,火焰黄色,产生大量白烟;火焰熄灭后,集气瓶底部有黑色固体,瓶壁上附着白色固体;B、集气瓶中加入适量蒸馏水,振荡、过滤,滤纸上留下黑色固体,滤液为无色;C、取适量滤液置于两支试管中,向第一支试管中滴加一滴酚酞溶液,溶液变红,向第二支试管中滴加澄清石灰水,溶液变浑浊。写出实验C中澄清石灰水变浑浊的化学方程式:____________,根据以上实验事实判断实验B中的无色滤液显________(填“酸性”、“碱性”或者“中性”),根据以上实验事实写出:钠在点燃条件下与CO2反应化学方程式:_______________;
(3)用胶头滴管将新制的饱和氯水慢慢滴入含有酚酞的氢氧化钠稀溶液中,当滴到一定量时,红色突然褪去。试回答下列问题,产生上述现象的原因,①可能是氯水呈酸性,与氢氧化钠溶液中和使溶液褪色;②也可能是_________;设计出一个方案证明红色褪去的原因是①或②_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属加工前常用盐酸对金属表面氧化物进行清洗,会产生酸洗废水。pH在2左右的某酸性废水含铁元素质量分数约3%,其他金属元素如铜、镍、锌浓度较低,综合利用酸洗废水可制备三氯化铁。制备过程如下:

相关金属离子生成氢氧化物沉淀的pH如下表:
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | Zn(OH)2 | |
开始沉淀的pH | 1.5 | 4.2 | 7.1 | 5.4 |
沉淀完全的pH | 3.7 | 6.7 | 9.2 | 8.0 |
回答下列问题:
(1)“中和”时调节pH至________,有利于后续制备得纯度较高的产品。
(2)处理酸洗废水中和后的滤渣,使铁元素浸出。按照不同的固液比投入“过滤”后滤渣和工业盐酸进行反应的铁浸出率如图所示,实际生产中固液比选择1.5∶1的原因是__________________。

(3)写出“氧化”中发生反应的离子方程式:____________________________________。
(4)“酸溶”后需根据溶液中Fe2+含量确定氧化剂的投入量。用K2Cr2O7标准溶液测定Fe2+(Cr2O![]() 被还原为Cr3+)的含量,该反应离子方程式为____________________________。
被还原为Cr3+)的含量,该反应离子方程式为____________________________。
(5) 将三氯化铁溶液在一定条件下________、________、过滤、洗涤、在氯化氢气氛中干燥得FeCl3·6H2O晶体,在实验室过滤装置中洗涤固体的方法是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
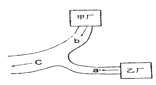
【题目】甲、乙两个化工厂分布在如图所示位置,箭头所指为工厂排水渠中水流方向。如果a处取得的水样经验测只含少量硝酸和硝酸钡,在c入取得的水样经检测pH=7,且只含少量硝酸钠,则b处的水中含有的物质应是下列物质中的
A. MgSO4、NaCl
B. K2SO4、NaOH
C. KOH、Na2SO4
D. NaOH、Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
B. 25℃时,NaB溶液的pH=8,c(Na+)- c(B-)=9.9×10-7 mol·L-1
C. 0.1 mol·L-1NaHCO3溶液:c(Na+)>c(oH-)>c(HCO3-)>c(H+)
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为:

若在反应中消耗了1 mol乙烷(反应物),则有关该反应的说法正确的是( )
A. 该反应放出251.2 kJ的热量 B. 该反应吸收251.2 kJ的热量
C. 该反应放出125.6 kJ的热量 D. 该反应吸收125.6 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,将a1 mL b1 mol·L-1 HCl加入到a2 mL b2 mol·L-1 NH3·H2O中,下列结论正确的是
A. 若混合液的pH<7,则:a1b1=a2b2
B. 若a1=a2且混合液的pH>7,则b1<b2
C. 若a1=a2、b1=b2,则混合溶液中: ![]()
D. 若混合后溶液pH=7,则混合溶液中: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 已知酸性![]() ,物质的量浓度相等的NaF与
,物质的量浓度相等的NaF与![]() 溶液中:c
溶液中:c![]()
B. 0.lmol·L-1的NaHX溶液pH为4,该溶液中: ![]()
C. 氯水中: ![]()
D. 25°C时,pH=8的![]() 溶液中,
溶液中,![]() 约为10-6mol·L-1
约为10-6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、也不会在空气中燃烧的气体,但能使带火星的木条复燃。

(1)A是________。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是_______________________。
(3)若C是一种黑色粉末,则B物质是________,C物质的作用是__________________。
(4)洗气瓶(广口瓶)中装的试剂D是________,其作用是_______。所制得的气体用________法收集。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com