
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图。
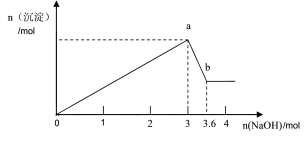
(1)a点对应的沉淀为________________(填化学式)。
(2)计算原混合液中FeCl3的物质的量浓度为多少_______________
【答案】Fe(OH)3和Al(OH)3 4mol/L
【解析】
FeCl3、AlCl3的混合溶液中加入氢氧化钠溶液,先发生的反应(oa段):Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,当沉淀达到最大量后发生反应(ab):Al(OH)3+OH-═AlO2-+2H2O,
(1)根据分析可知,a点生成的沉淀为Fe(OH)3和Al(OH)3;
(2)ab段氢氧化铝开始溶解,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
设FeCl3、AlCl3的物质的量分别为x、y,
0~a段反应,消耗NaOH溶液3mol
Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,
1mol 3mol 1mol 3mol 1mol
x 3x y 3y y
3x+3y=3mol①
a~b段反应,消耗NaOH溶液(3.6-3)mol
Al(OH)3+OH-═AlO2-+2H2O
1mol 1mol
y y
y=0.6mol②
由①②解得x=0.4mol,
即FeCl3的物质的量为0.6mol,c=0.4mol÷0.1L=4mol·L-1。


科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL0.50mol/L的盐酸于50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法中,正确的是( )
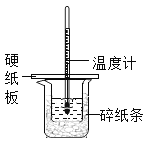
A. 烧杯间填满碎纸条的作用是固定小烧杯
B. 用如图装置可以完成中和热测定的实验
C. 为防止混合溶液时溅出产生误差,因此混合时速度要慢
D. 若将盐酸体积改为60mL,不考虑热量损失,理论上所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氧化锌作催化剂、以乙二醇和碳酸氢钠为复合解聚剂常压下快速、彻底解聚聚对苯二甲酸乙二醇酯,同时回收对苯二甲酸和乙二醇。反应原理如下:

实验步骤如下:
步骤1:在题图1所示装置的四颈烧瓶内依次加入洗净的矿泉水瓶碎片、氧化锌、碳酸氢钠和乙二醇,缓慢搅拌,油浴加热至180 ℃,反应0.5 h。

步骤2:降下油浴,冷却至160 ℃,将搅拌回流装置改为图2所示的搅拌蒸馏装置,水泵减压,油浴加热蒸馏。
步骤3:蒸馏完毕,向四颈烧瓶内加入沸水,搅拌。维持温度在60 ℃左右,抽滤。
步骤4:将滤液转移至烧杯中加热煮沸后,趁热边搅拌边加入盐酸酸化至pH为1~2。用砂芯漏斗抽滤,洗涤滤饼数次直至洗涤滤液pH=6,将滤饼摊开置于微波炉中微波干燥。
请回答下列问题:
(1) 步骤1中将矿泉水瓶剪成碎片的目的是______________________________。
(2) 步骤2中减压蒸馏的目的是____________________,蒸馏出的物质是________。
(3) 抽滤结束后停止抽滤正确的操作方法是________。若滤液有色,可采取的措施是________。
(4) 该实验中,不采用水浴加热的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是______,氧化产物与还原产物的物质的量之比为_______。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):① ___KMnO4+____K2S+______===___K2MnO4+___K2SO4+___S↓+______。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为___。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应:![]()
(1)配平上述化学方程式并标出该反应中电子转移情况_____________________________
(2)该反应中的氧化剂是__________ ,被氧化的元素是_____________。
(3)1 mol Cl2参加反应,被氧化的NH3 的物质的量是_____________mol。
(4)若有68g NH3参加反应,电子转移的物质的量是_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是
A. 称量NaCl固体时砝码上有杂质
B. 没有洗涤溶解NaCl固体的烧杯和玻璃棒
C. 定容时加水加多了,用滴管吸出溶液至刻度线
D. 定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 氯化铁腐蚀铜板:Fe3++Cu===Fe2++Cu2+
B. 实验室制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. 稀硫酸中加氢氧化钡溶液至溶液呈中性:Ba2++H++OH-+SO![]() ===BaSO4↓+H2O
===BaSO4↓+H2O
D. 用氢氧化钠溶液吸收少量二氧化硫:2OH-+SO2 ===SO![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种著名的香料,某研究小组从苯出发,经两条路线合成化合物H。其中化合物D的分子式为C7H8 。
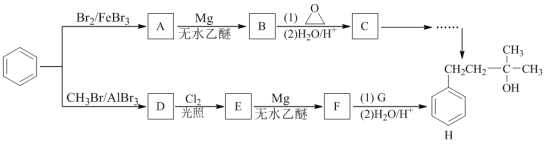
已知:I. RX+Mg无水乙醇R-MgX (X为卤素原子)
II. ![]()
III. 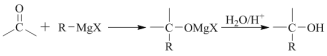
请回答:
(1)下列说法不正确的是________________________。
A.常温下,化合物A为褐色、密度比水大的液体
B.化合物C能发生消去反应
C.化合物D的一氯代物有4种
D.化合物E能发生水解反应和消去反应
(2)苯→D的化学方程式是___________________________________________。
(3)G的结构简式是_______________________________________。
(4)写出同时符合下列条件的C的所有同分异构体的结构简式________________________。
①能与FeCl3溶液发生显色反应;
②1H-NMR谱显示分子中含有四种不同环境的氢原子。
(5)设计以C和丙酮为原料制备H的合成路线(用流程图表示,无机试剂任选,且不超过四步)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂锂离子电池充电时阳极反应式为,![]() ,放电工作示意图如图。下列叙述不正确的是
,放电工作示意图如图。下列叙述不正确的是

A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:![]()
D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com