
【题目】以硫铁矿为原料制备氯化铁晶体(FeCl3·6H2O,270.5 g·mol-1)的工艺流程如图所示。

请回答下列问题:
(1)为加快焙烧反应的化学反应速率,可采取的措施为______、__________。(任写两条)
(2)焙烧后得到的Fe2O3在酸溶过程中发生反应的离子方程式为__________。
(3)过滤操作用到的玻璃仪器有烧杯、________、________。
(4)焙烧过程中产生的SO2可用过量的氨水进行吸收,所得溶液中溶质的名称为______、______。
(5)先向氯化铁溶液中加适量盐酸的目的是_________,再____、______、过滤、洗涤,最终得到氯化铁晶体。
【答案】粉碎硫铁矿 鼓入热的压缩空气 Fe2O3+6H+=2Fe3++3H2O 漏斗 玻璃棒 亚硫酸铵 一水合氨 抑制Fe3+的水解 (在HCl气氛中)蒸发浓缩 冷却结晶
【解析】
根据流程,黄铁矿在高温下煅烧可以得到铁的氧化物,将其溶于盐酸中,可以得到含有铁离子的盐溶液,氯化铁溶液蒸发浓缩、冷却结晶就可以得到氯化铁的晶体。
(1)为加快焙烧反应的化学反应速率,可采取的措施为粉碎硫铁矿、鼓入热的压缩空气。
(2)焙烧后得到的Fe2O3在酸溶过程中得到氯化铁溶液和水,发生反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O。
(3)过滤操作用到的玻璃仪器有烧杯、漏斗、玻璃棒。
(4)焙烧过程中产生的SO2可用过量的氨水进行吸收生成亚硫酸铵和水,所得溶液中溶质的名称为亚硫酸铵、过量的氨水,溶质为一水合氨。
(5)铁离子易水解,先向氯化铁溶液中加适量盐酸的目的是抑制Fe3+的水解,再(在HCl气氛中)蒸发浓缩、冷却结晶、过滤、洗涤,最终得到氯化铁晶体。


科目:高中化学 来源: 题型:
【题目】可逆反应A+a B![]() C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是

A.T2>T1,p2>p1
B.该反应为放热反应
C.若a=2,则A为液态或固态物质
D.增加B的物质的量,该反应的![]() H增大
H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去,查阅资料可知: 常温下,部分阳离子以氢氧化物形式沉淀时溶液的 pH 如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的 pH | 1.9 | 7.0 | 4.3 |
沉淀完全的 pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原 Cr(VI)。下列关于铁屑的说法中正确的是______________(填字母序号)。
a.作原电池的正极 b.在反应中作还原剂 c.铁屑生成 Fe3+可以进一步还原![]()
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如下图所示。

(2)B极连接电源的___________极;
(3)电解开始时,B 极上主要发生的电极反应为2H++2e-= H2↑,此外还有少量![]() 在B极上直接放电,该反应的电极反应式为 _______________。
在B极上直接放电,该反应的电极反应式为 _______________。
(4)①酸性环境可以促使![]() 到
到![]() 的转化,写出对应的离子方程式:__________________;
的转化,写出对应的离子方程式:__________________;
②写出酸性环境中 Fe2+还原![]() 的离子方程式_______________________。
的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数的描述中正确的是( )
A. 化学平衡常数的大小取决于化学反应本身,与其他外界条件无关
B. 相同温度下,反应A+BC与反应CA+B的化学平衡常数相同
C. 反应2SO2(g)+O2(g)2SO3(g) ΔH<0的化学平衡常数随温度升高而增大
D. 反应A(g)+B(g)2C(g)的平衡常数表达式为K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以[Zn(NH3)4]2+、[Cu(NH3)4]2+、[Cd(NH3)4]2+、[AsCl5]2-的形式存在。
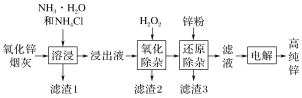
“氧化除杂”中,[AsCl5]2-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性,该反应的离子方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) (CH3CH2)2CHCH3的正确命名是______________,该烃是某炔烃经催化加氢后得到,那么炔烃的结构简式是__________ ,正确命名是____________。
(2)苯酚和浓溴水反应:_________,反应类型____________。
(3)(CH3)2C(OH)CH(OH)CH2OH发生催化氧化反应:_________。
(4)两种饱和一元脂肪醛的混合物,其平均相对分子质量为51。取4.08 g混合物与足量银氨溶液共热,生成银21.6 g。试通过计算判断这两种醛的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
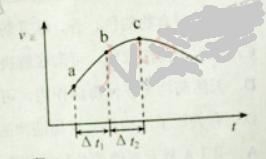
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置 于密闭的窗口中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:![]() △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应:![]()
D.钢铁腐蚀时可能发生的正极反应:2H2O+ O2+ 4e-=4OH一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应且能量变化符合图像的是
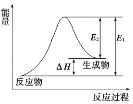
A.C(s)+CO2(g) = 2CO(g)
B.CH4(g)+2O2(g) = CO2(g)+2H2O(l)
C.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l)
D.Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(aq)+2NH3(g)+10H2O(l)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com