
【题目】下列反应属于氧化还原反应且能量变化符合图像的是
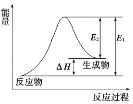
A.C(s)+CO2(g) = 2CO(g)
B.CH4(g)+2O2(g) = CO2(g)+2H2O(l)
C.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l)
D.Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(aq)+2NH3(g)+10H2O(l)
科目:高中化学 来源: 题型:
【题目】以硫铁矿为原料制备氯化铁晶体(FeCl3·6H2O,270.5 g·mol-1)的工艺流程如图所示。

请回答下列问题:
(1)为加快焙烧反应的化学反应速率,可采取的措施为______、__________。(任写两条)
(2)焙烧后得到的Fe2O3在酸溶过程中发生反应的离子方程式为__________。
(3)过滤操作用到的玻璃仪器有烧杯、________、________。
(4)焙烧过程中产生的SO2可用过量的氨水进行吸收,所得溶液中溶质的名称为______、______。
(5)先向氯化铁溶液中加适量盐酸的目的是_________,再____、______、过滤、洗涤,最终得到氯化铁晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
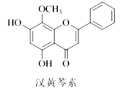
A.该物质遇FeCl3溶液不显色
B.汉黄芩素的分子式为C16H12O5
C.1 mol该物质与溴水反应,最多消耗1 mol Br2
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理某废水时,反应过程中部分离子浓度与反应进程关系如下图,反应过程中主要存在N2、HCO3、ClO、CNO(C+4价,N-3价)、Cl等微粒。下列说法不正确的是

A.该废水呈强酸性
B.废水处理后转化为无害物质
C.反应的离子方程式:3ClO+2CNO+H2O == N2+2HCO3+3Cl
D.每处理1 mol CNO转移3 mol e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素的最高价氧化物对应水化物的化学式分别为![]() 和
和![]() 。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是( )
。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是( )
A.原子半径:![]()
B.氢化物稳定性:![]()
C.原子核内质子数:![]()
D.最高价氧化物对应水化物的碱性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是
A.H+、Fe2+、![]() 、
、![]() B.Na+、OH-、
B.Na+、OH-、![]() 、
、![]()
C.Na+、Al3+、Cl-、![]() D.Fe3+、K+、SCN-、Cl-
D.Fe3+、K+、SCN-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
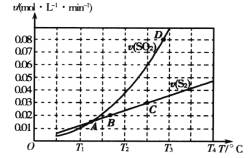
A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对于反应:2HI(g)![]() H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.棕红色气体NO2(2NO2![]() N2O4)缩小体积加压后,颜色先变深后变浅
N2O4)缩小体积加压后,颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙醇和金属钠反应生成![]() 的原理,某同学做了如下四个实验。
的原理,某同学做了如下四个实验。
甲:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体
乙:设法检验甲收集到的气体。
丙:向试管中加人![]() 水,并加入绿豆粒大小的金属钠,观察现象。
水,并加入绿豆粒大小的金属钠,观察现象。
丁:向试管中加人![]() 乙醚(
乙醚(![]() ),并加入绿豆粒大小的金属钠,发现无明显变化。
),并加入绿豆粒大小的金属钠,发现无明显变化。
回答以下问题:
(1)从结构上分析,该实验选取水和乙醚作参照物的原因是__________。
(2)丙的目的是证明_____________;丁的目的是证明_______;根据丙和丁的结果,可以得出乙醇和金属钠反应的化学方程式应为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com