
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2+3H2![]() 2NH3 △H<0。
2NH3 △H<0。
(1)反应开始阶段,v(正)______(填“>”“<”或“=”)v(逆),随后v(正)逐渐______ (填“增大”或“减小”,下同),v(逆)逐渐______,反应达到平衡时,v(正)______ (填“>”“<”或“=”)v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v’(H2)表示,则v(N2)=____v’(H2)。
(3)下列措施中能加快反应速率并提高氢气的转化率的是______(填字母)。
A.其他条件不变时,压缩容器体积 B.其他条件不变时,升高反应体系温度
C.使用合适的催化剂 D.保持容器体积不变,充入一定量的氮气
(4)实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因是______________________________________。
(5)写出合成氨反应N2+3H2![]() 2NH3的平衡常数表达式:____________________,升高温度时K值______(填“增大”“减小”或“不变”)。
2NH3的平衡常数表达式:____________________,升高温度时K值______(填“增大”“减小”或“不变”)。
【答案】> 减小 增大 = ![]() AD 升高温度平衡逆向移动,不利于提高N2的转化率,但温度过低,反应速率缓慢, K=
AD 升高温度平衡逆向移动,不利于提高N2的转化率,但温度过低,反应速率缓慢, K=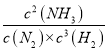 减小
减小
【解析】
(1)反应开始阶段,正反应速率大于逆反应速率,随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大,达到平衡时,正逆反应速率相等;
(2)达到平衡时正逆反应速率相等,且满足反应速率之比等于化学计量数之比;
(3)一般来说,升高温度、增大浓度、缩小体积以及加入催化剂等,可加快反应速率,再结合温度、压强和催化剂对平衡的影响分析;
(4)可结合温度对速率和平衡的影响分析;
(5)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值。
(1)反应开始阶段,正反应速率大于逆反应速率,随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大,达到平衡时,正逆反应速率相等;
(2)达到平衡时正逆反应速率相等,且满足反应速率之比等于化学计量数之比,则V(N2)=![]() v'(H2);
v'(H2);
(3) A.其他条件不变时,压缩容器体积,压强增大,反应速率加快,且平衡正向移动,H2的转化率增大,故A正确;
B.其他条件不变时,升高反应体系温度,反应速率加快,但平衡逆向移动,H2的转化率减小,故B错误;
C.使用合适的催化剂,加快反应速率,不影响平衡的移动,H2的转化率不变,故C错误;
D.保持容器体积不变,充入一定量的氮气,氮气的浓度增大,反应速率加快,且平衡正向移动,H2的转化率增大,故D正确;
故答案为AD;
(4)反应N2+3H2![]() 2NH3 △H<0,升高温度平衡逆向移动,不利于提高N2的转化率,但温度过低,反应速率缓慢,故实际生产中往往需要将温度控制在一个合适的范围,即综合考虑转化率和反应速率;
2NH3 △H<0,升高温度平衡逆向移动,不利于提高N2的转化率,但温度过低,反应速率缓慢,故实际生产中往往需要将温度控制在一个合适的范围,即综合考虑转化率和反应速率;
(5)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值,K=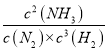 ,当温度升高时,平衡逆向移动,平衡常数K值减小。
,当温度升高时,平衡逆向移动,平衡常数K值减小。


科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
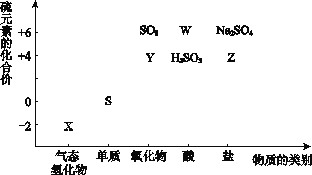
(1)Y的化学式为_________,检验Y所用的试剂是________________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中![]() 与
与![]() 有如图所示关系。下列说法正确的是
有如图所示关系。下列说法正确的是![]()
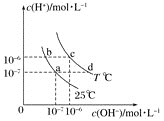
A.b点溶液中不可能存在![]()
B.b、c两点pH相同,但溶液的酸碱性不同
C.通过降温的方法,可使溶液的状态从d点变为a点
D.a点溶液中可能大量共存的离子:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,CuSO4·5H2O(s)、CuSO4(s)与其水溶液之间转化的焓变关系如图:
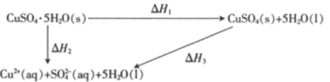
已知CuSO4·5H2O(s)溶于水,溶液温度降低;CuSO4(s)溶于水,溶液温度升高。下列有关说法正确的是
A.从硫酸铜溶液中析出CuSO4·5H2O(s)的反应焓变△H>0
B.1 mol CuSO4(s)的总能量大于1 mol Cu2+(aq)与1 mol SO42-(aq)的总能量
C.△H2>△H1
D.△H1=△H2+△H3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。

回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:___________、__________。
(3)得到FeSO47H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.2mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
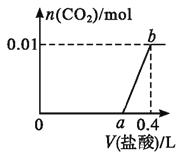
A.在0~a范围内,只发生反应OH-+H+=H2O
B.a=0.35
C.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质—青蒿素而荣获2015年诺贝尔奖。科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚。下列说法正确的是
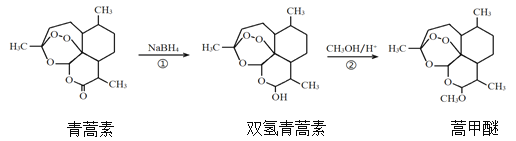
A.利用黄花蒿叶研究青蒿素结构的基本步骤为:元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B.①、②的反应类型分别为还原反应、酯化反应
C.双氢青蒿素在水中的溶解性大于青蒿素
D.双氢青蒿素与蒿甲醚组成上相差-CH2-,二者互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常用无水乙醇和浓硫酸加热到170℃制取乙烯,反应方程式为:CH3CH2OH![]() CH2=CH2↑+H2O。若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g)。
CH2=CH2↑+H2O。若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g)。
(1)试用下图所示的装置设计一个实验,验证制得的气体中含有杂质气体:二氧化碳,二氧化硫和水蒸气,按气流的方向,各装置的连接顺序是 。

(2)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则B瓶的作用是 ,C瓶的作用是 。
(3)若气体通过装置③中所盛溶液时,产生白色沉淀,它可以用来验证的气体是____。
(4)装置②中所加的试剂名称是____ _______。
(5)乙烯在一定条件下能制得聚乙烯,写出相应的化学反应方程式: 。
(6)某同学做此实验时发现装置④存在的不妥之处是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)电镀厂的废水中含有的CN有剧毒,需要处理加以排放。处理含CN废水的方法之一是在微生物的作用下,CN被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为__。
(2)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A表示乳酸根离子):
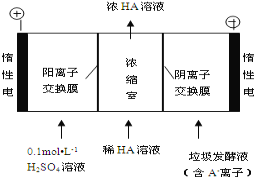
①阳极的电极反应式为___。
②简述浓缩室中得到浓乳酸的原理:__。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH可忽略不计。400mL10g/L乳酸溶液通电一段时间后,浓度上升为145g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为__L(提示:乳酸的摩尔质量为90g/mol)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com