
【题目】铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。
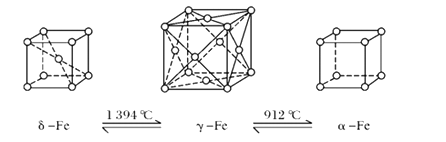
(1)δ、γ、α三种晶体晶胞中铁原子的配位数之比为_________。
(2)若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶胞空间利用率之比为________(用a、b表示)
(3)若Fe原子半径为r pm,NA表示阿伏加德罗常数的值,则γ-Fe单质的密度为_______g/cm3(用含r的表达式表示、列出算式即可)
(4)三氯化铁在常温下为固体,熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为______。
【答案】4:6:3 2b3:a3 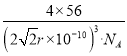 分子晶体
分子晶体
【解析】
(1)根据各种晶体结构中微粒的空间位置确定三种晶体晶胞中铁原子的配位数,然后得到其比值;
(2)先计算出两种晶体中Fe原子个数比,然后根据密度定义计算出其密度比,就得到其空间利用率之比;
(3)先计算γ-Fe晶体中Fe原子个数,根据Fe原子半径计算晶胞的体积,然后根据![]() 计算晶体的密度;
计算晶体的密度;
(4)根据物质的熔沸点、溶解性等物理性质分析判断。
(1) δ-Fe晶体中与每个铁原子距离相等且最近的铁原子是晶胞顶点的Fe异种,个数是8个;
γ-Fe晶体中与每个铁原子距离相等且最近的铁原子个数=3×![]() ×8=12;
×8=12;
α-Fe晶体中与每个铁原子距离相等且最近的铁原子是相邻顶点上铁原子,铁原子个数=2×3=6;
则三种晶体晶胞中铁原子的配位数的比为8:12:6=4:6:3;
(2)若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体中铁原子个数之比=(1+![]() ):(8×
):(8×![]() )=2:1,密度比=
)=2:1,密度比=![]() :
:![]() =2b3:a3,晶体的密度比等于物质的空间利用率之比,所以两种晶体晶胞空间利用率之比为2b3:a3;
=2b3:a3,晶体的密度比等于物质的空间利用率之比,所以两种晶体晶胞空间利用率之比为2b3:a3;
(3)在γ-Fe晶体中Fe原子个数为8×![]() +6×
+6×![]() =4,Fe原子半径为r pm,假设晶胞边长为L,则
=4,Fe原子半径为r pm,假设晶胞边长为L,则![]() L=4rpm,所以L=2
L=4rpm,所以L=2![]() rpm=2
rpm=2![]() ×10-10cm,则晶胞的体积V=L3=(2
×10-10cm,则晶胞的体积V=L3=(2![]() ×10-10)cm3,所以γ-Fe单质的密度
×10-10)cm3,所以γ-Fe单质的密度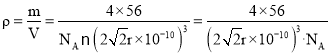 ;
;
(4)FeCl3晶体的熔沸点低,易溶于水,也易溶于乙醚、丙酮等有机溶剂,根据相似相溶原理,结合分子晶体熔沸点较低,该物质的熔沸点较低,属于分子晶体。


科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由 Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有________个未成对电子。Fe3+的电子排布式为_______________。
(3)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为________,1 mol乙醛分子中含有的σ键的数目为________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有__________个铜原子。锗也是一种半导体材料,Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是______________________________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图:

镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
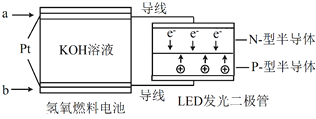
A. 电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
B. a处通入氢气, b处通氧气,该装置将化学能最终转化为电能
C. 电池放电后, OH-的物质的量浓度减小
D. 通入O2的电极发生反应:O2 + 4e- = 2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。
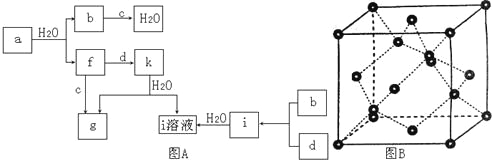
回答下列问题:
(1)图B对应的物质名称是_________,其晶胞中的原子数为______,晶体类型为_______。
(2)d中元素的原子核外电子排布式为_______。
(3)图A中由二种元素组成的物质中,沸点最高的是______,原因是______,该物质的分子构型为_________,中心原子的杂化轨道类型为_________。
(4)图A中的双原子分子中,极性最大的分子是_________。
(5)k的分子式为_________,中心原子的杂化轨道类型为_________,属于_________分子(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.28g晶体硅中含有NA个Si-Si键
B.叠氮化铵(NH4N3)发生爆炸反应:NH4N3=2N2![]() +2H2
+2H2![]() ,当产生标准状况下22.4L气体时,转移电子的数目为NA
,当产生标准状况下22.4L气体时,转移电子的数目为NA
C.pH=1的H3PO4溶液中所含H+的数目为0.1NA
D.200mL1mol/LAl2(SO4)3溶液中A13+和SO42-的数目总和是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是( )
A. NO2溶于水:3NO2+H2O=2H++2NO3-+NO
B. 漂白粉溶液呈碱性的原因:ClO-+H2O![]() HClO+OH-
HClO+OH-
C. 酸性条件下用H2O2将海带灰中I-氧化:H2O2+2I-+2H+=I2+2H2O
D. 氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Cu2S(s)![]() CuO(s)
CuO(s)![]() CuCl2(aq)
CuCl2(aq)
B.SiO2(s)![]() H2SiO3(s)
H2SiO3(s)![]() Na2SiO3(aq)
Na2SiO3(aq)
C.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
D.NaCl(aq)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O_____
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn.
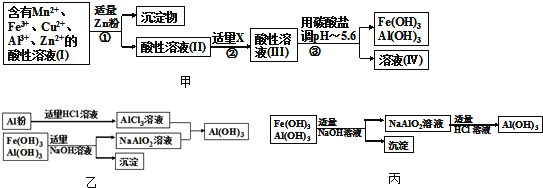
a、操作①中加Zn粉后发生反应的离子方程式为 ______ .
b、操作②中加入适量X的作用是什么 ______ ;X的首选物的化学式是: ______ .
c、操作③中所加碳酸盐的化学式是 ______ .
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为 ______ .若总共得到nmol Al(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 ______ 、 ______ .
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量? ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com