
【题目】某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O_____
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn.
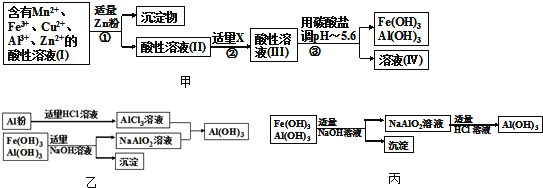
a、操作①中加Zn粉后发生反应的离子方程式为 ______ .
b、操作②中加入适量X的作用是什么 ______ ;X的首选物的化学式是: ______ .
c、操作③中所加碳酸盐的化学式是 ______ .
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为 ______ .若总共得到nmol Al(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 ______ 、 ______ .
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量? ______ .
【答案】3MnO2+ 2FeS +6 H2SO4 = 3MnSO4 + Fe2(SO4)3+2S+6H2O Zn+2Fe3+=Zn2++2Fe2+,Zn + Cu2+ =Zn2+ + Cu 将Fe2+氧化成Fe3+ MnO2 MnCO3或ZnCO3 Al3++3AlO2-+6H2O=4 Al(OH)3↓ ![]()
![]() 按丙流程,则得到同样nmolAl(OH)3,消耗的NaOH、HCl的理论量均为nmol,大于乙流程的消耗量,相对而言,乙流程更符合节约的原则。
按丙流程,则得到同样nmolAl(OH)3,消耗的NaOH、HCl的理论量均为nmol,大于乙流程的消耗量,相对而言,乙流程更符合节约的原则。
【解析】
⑴根据氧化还原反应配平方程式。
⑵加入锌,先是铁离子反应,再是铜离子反应,为了除掉铁元素,用氧化剂氧化亚铁离子变为铁离子,再通过调节溶液的pH值来除掉铁离子,一般用碳酸锰等。
⑶得到nmol氢氧化铝,根据化学方程式求出需要的铝离子和偏铝酸根离子的物质的量,再根据方程式计算需要消耗得盐酸和氢氧化钠的物质的量,分析乙、丙两种流程得到的相同的氢氧化铝消耗的盐酸和氢氧化钠的量来得出哪种方式更优。
⑴在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2中Mn的化合价降低2价,1molMnO2得到2mol电子,FeS中铁和硫的化合价都升高,1molFeS失去3mol电子,因此转移电子数为6,在FeS前面配系数2,MnO2配系数为3,再根据质量守恒配平其他物质的系数:3MnO2+ 2FeS +6H2SO4 = 3MnSO4 + Fe2(SO4)3+2S+6H2O,故答案为:3MnO2+ 2FeS +6H2SO4 = 3MnSO4 + Fe2(SO4)3+2S+6H2O。
⑵a、操作①中加Zn粉后发生反应的离子方程式为Zn+2Fe3+=Zn2++2Fe2+,Zn + Cu2+ =Zn2+ + Cu,故答案为:Zn+2Fe3+=Zn2++2Fe2+,Zn + Cu2+ =Zn2+ + Cu。
b、后面要将铁元素除掉,因此要先将亚铁离子氧化,操作②中加入适量X的作用是将Fe2+氧化成Fe3+,为了不引入新的杂质,因此X的首选物的化学式是:MnO2,故答案为:将Fe2+氧化成Fe3+,MnO2。
c、不引入新的杂质且要调节溶液的pH值,则操作③中所加碳酸盐的化学式是MnCO3或ZnCO3或MnCO3,故答案为:MnCO3或ZnCO33。
⑶a、流程乙中发生反应的离子方程式为:2Al+6H+=2Al3++3H2↑,Al(OH)3+OH-=AlO2-+2H2O,Al3++3AlO2-+6H2O=4 Al(OH)3↓,若总共得到n mol Al(OH)3,根据方程式,需要AlO2-的物质的量为![]() mol,则需要NaOH的物质的量为
mol,则需要NaOH的物质的量为![]() mol,Al3+的物质的量为
mol,Al3+的物质的量为![]() mol,消耗盐酸的物质的量为
mol,消耗盐酸的物质的量为![]() mol,因此消耗的NaOH和HCl的理论量(mol)分别为
mol,因此消耗的NaOH和HCl的理论量(mol)分别为![]() mol、
mol、![]() mol,故答案为:Al3++3AlO2-+6H2O=4 Al(OH)3↓;
mol,故答案为:Al3++3AlO2-+6H2O=4 Al(OH)3↓;![]() ;
;![]() 。
。
b、若使用如图丙流程回收处理,发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,AlO2-+H++H2O=Al(OH)3↓,生成n mol Al(OH)3,需要n mol盐酸和n mol偏铝酸根,生成n mol偏铝酸根需要n mol氢氧化铝和n mol氢氧化钠,因此按丙流程,则得到同样nmolAl(OH)3,消耗的NaOH、HCl的理论量分别为nmol,大于乙流程的消耗量,相对而言,乙流程更符合节约的原则,故答案为:按丙流程,则得到同样nmolAl(OH)3,消耗的NaOH、HCl的理论量分别为nmol,大于乙流程的消耗量,相对而言,乙流程更符合节约的原则。


科目:高中化学 来源: 题型:
【题目】铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。
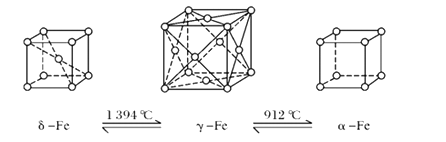
(1)δ、γ、α三种晶体晶胞中铁原子的配位数之比为_________。
(2)若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶胞空间利用率之比为________(用a、b表示)
(3)若Fe原子半径为r pm,NA表示阿伏加德罗常数的值,则γ-Fe单质的密度为_______g/cm3(用含r的表达式表示、列出算式即可)
(4)三氯化铁在常温下为固体,熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:
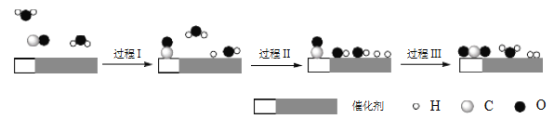
下列说法正确的是
A. 过程Ⅰ、过程Ⅲ均为放热过程
B. 过程Ⅲ生成了具有极性共价键的H2、CO2
C. 使用催化剂降低了水煤气变换反应的ΔH
D. 图示过程中的H2O均参与了反应过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。

完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | B→D→E | ___ |
(2) | 乙炔 | ___ | ___ |
(3)D装置中氢氧化钠溶液的作用___。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯![]() 甲
甲![]() 乙
乙![]() PVC
PVC
(4)甲的结构简式是___;
(5)反应③的化学方程式是__。
(6)下列说法正确的是___。
A.乙烯可以作为植物生长调节剂
B.PVC不能使酸性高锰酸钾溶液褪色
C.PVC中的官能团是碳碳双键和氯原子
查看答案和解析>>
科目:高中化学 来源: 题型:
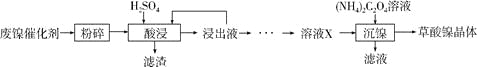
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Al3+ | 3.0 | 5.0 |
Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。
(1)“粉碎”的目的是____________。
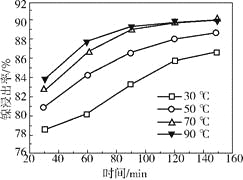
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为_________(填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是___________。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是_________________。
②烘干温度不超过110℃的原因是_________________。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,___,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:___,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用。其工作流程如下图所示:
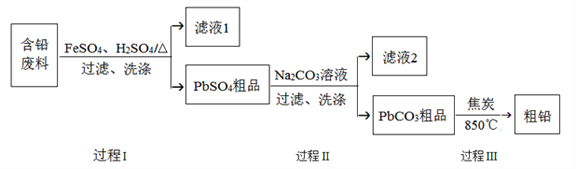
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42-![]() 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.___________。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42-)=1.6mol/L,c(CO32-)=0.1mol/L,则PbCO3中____(填“是”或“否”)混有PbSO4。
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发 生反应:PbSO4+3OH-=HPbO2-+SO42-+H2O。
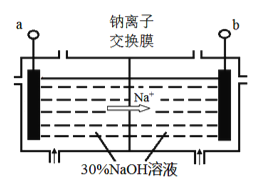
①a与外接电源的________极相连。
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为___________。
③与传统无膜固相电解法相比,使用钠离子交换膜可以 提高Pb元素的利用率,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是依据各种元素(原子)的性质与原子序数(1~20)的关系而绘制出来的,各图的纵轴可能代表下列某一性质:核电荷数,中子数、最高正化合价、原子半径、得电子能力,A、B、C分别代表三种元素.(注意:图3中原子序数为8、9的元素和图4中原子序数为2、10、18的元素在纵轴上没有对应的数值.)
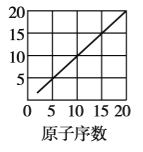
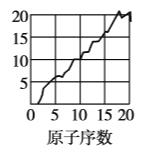
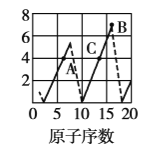
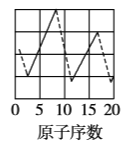
请回答下列问题:
(1)图2的纵轴代表的性质是______,图4的纵轴代表的性质是______.
(2)A元素的最低负化合价为______.
(3)B、C两种元素形成的化合物中,C显最高正化合价而B显最低负化合价,该化合物的化学式为______.
(4)1~20号元素中,原子(稀有气体元素原子除外)半径最大的是__(填元素符号)
(5)写出B的单质与NaOH溶液反应的离子方程式:____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 为核电荷数小于18的两种元素,元素
为核电荷数小于18的两种元素,元素![]() 的原子的最外层电子数是次外层电子数的一半,元素
的原子的最外层电子数是次外层电子数的一半,元素![]() 的原子的最外层电子数与最内层电子数之和等于次外层电子数。下列有关叙述正确的是
的原子的最外层电子数与最内层电子数之和等于次外层电子数。下列有关叙述正确的是
A.![]() 、
、![]() 一定是非金属元素B.
一定是非金属元素B.![]() 的最外层电子数比
的最外层电子数比![]() 的少
的少
C.![]() 的单质在化学反应中只能作还原剂D.
的单质在化学反应中只能作还原剂D.![]() 与
与![]() 的最外层电子数相等
的最外层电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β-羰基酯,同时失去一分子醇,该反应称克菜森(R·L·Claisen)酯缩合反应,其反应机理如下:
2RCH2COOC2H5 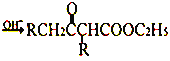 +C2H5OH 利用Claisen反应制备化合物I的一种合成路线如下:
+C2H5OH 利用Claisen反应制备化合物I的一种合成路线如下:
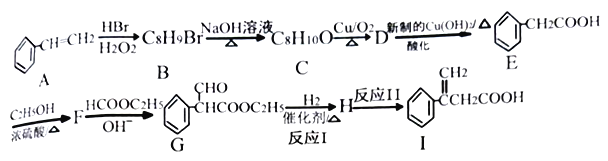
回答下列问题:
(1)E的名称为_______,F的结构简式为_______。
(2)I中官能团的名称是_______,反应I的反应类型是_______。
(3)F→G反应的化学方程式为_______。
(4)满足下列条件E的同分异构体有_____种。
①含有苯环,能发生水解反应 ②分子结构中含有一个甲基
其中分子结构中只有一个侧链的有机物结构简式为______、_______。
(5)乙酰乙酸乙酯(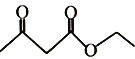 )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线________(无机试剂任选)。
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com