
【题目】2,3,5-三溴苯甲酸(H)是一种新型植物生长调节剂,应用于农作物,具有高效、低毒、调节作物生长、增产效果明显等特性。其合成路线如图所示:
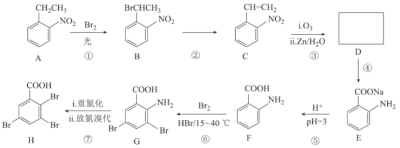
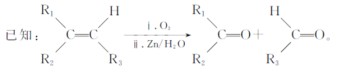
回答下列问题:
(1)反应①的反应类型为__。
(2)写出反应②所需的试剂和条件:__。
(3)同时满足下列条件的B的同分异构体有__种(不含立体异构),任写其中一种结构简式:__。
i.属于芳香族化合物,且官能团种类与B相同。
ii.核磁共振氢谱显示有4组峰,且峰面积之比为1:1:1:1。
(4)D的结构简式为__。
(5)H中所含官能团的名称为__。
(6)写出反应⑥的化学方程式:__。
(7)参照上述合成路线和信息,设计由1-丁烯(无机试剂任选)制备丙酸甲酯的合成路线:__。
【答案】取代反应 氢氧化钠,醇溶液加热 3 ![]() (其他答案合理即可)
(其他答案合理即可) ![]() 羧基、溴原子
羧基、溴原子 ![]()
【解析】
⑴根据A到B的原子分析得到反应①的反应类型。
⑵反应②类似卤代烃变为碳碳双键,发生消去反应。
⑶i.属于芳香族化合物,且官能团种类与B相同,有—Br,—NO2;ii.核磁共振氢谱显示有4组峰,且峰面积之比为1:1:1:1,说明每种峰有2个氢,有对称性。
⑷根据信息和C到D的反应,得出D的结构简式。
⑸根据H的结构简式得出官能团的名称。
⑹反应⑥是发生取代反应。
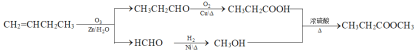
⑺根据信息,将1-丁烯(CH2=CHCH2CH3)与O3、Zn、H2O变为CH3CH2CHO和HCHO,再分别催化氧化和加氢,再两者酯化反应。
⑴根据A到B的原子分析得到反应①的反应类型为取代反应;故答案为:取代反应。
⑵反应②类似卤代烃变为碳碳双键,发生消去反应,因此所需的试剂和条件:氢氧化钠,醇溶液加热;故答案为:氢氧化钠,醇溶液加热。
⑶ i.属于芳香族化合物,且官能团种类与B相同,有—Br,—NO2。
ii.核磁共振氢谱显示有4组峰,且峰面积之比为1:1:1:1,说明每种峰有2个氢,有对称性,因此—CH2CH2Br、—NO2连接苯的对位,—CH2CH2NO2、—Br连接苯的对位,—CH2NO2、—CH2Br连接苯的对位,共3种;故答案为:3。
⑷根据信息和C到D的反应,得出D的结构简式为![]() ;故答案为:
;故答案为:![]() 。
。
⑸H中所含官能团的名称为羧基和溴原子;故答案为:羧基、溴原子。
⑹反应⑥是发生取代反应,其化学方程式:![]() ;故答案为:
;故答案为:![]() 。
。
⑺根据信息,将1-丁烯(CH2=CHCH2CH3)与O3、Zn、H2O变为CH3CH2CHO和HCHO,CH3CH2CHO催化氧化变为CH3CH2COOH,HCHO加氢变为CH3OH,两者反应生成CH3CH2COOCH3,制备丙酸甲酯的合成路线: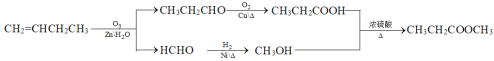 ;故答案为:
;故答案为: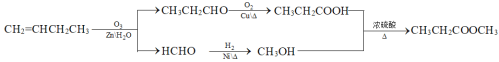 。
。


科目:高中化学 来源: 题型:
【题目】国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
请回答下列问题:
(1)邻氨基吡啶(![]() )的铜配台物在有机不对称合成中起催化诱导效应。
)的铜配台物在有机不对称合成中起催化诱导效应。
①邻氨基吡啶中所有元素的电负性出小到大的顺序为__(填元素符号)。设NA为阿伏加德罗常数的值,1mol![]() 中含有σ键的数目为__。
中含有σ键的数目为__。
②一定条件下-NH2可以被氧化成-NO2,-NO2中N原子的杂化方式为__杂化。
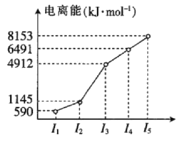
(2)第四周期的某主族元素,其第一至第五电离能数据如图所示,则该元素的基态原子电子排布式为___。
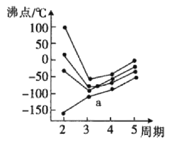
(3)元素周期表中的第IVA族~第VIIA族中部分元素的最简单氢化物的沸点变化趋势线如图,其中一个小黑点代表-种氢化物,则趋势线a代表第__族元素的最简单氢化物的沸点变化趋势,判断依据是__。
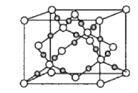
(4)干冰是常见的分子晶体,而CO2在高温高压下能形成另一种晶体其晶胞如图所示,该CO2晶体的熔点__(填“>”“<”或“=”)SiO2晶体的熔点。
(5)一种嘌呤和一种吡啶的结构如图。
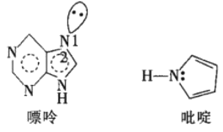
①嘌呤中轨道之间的夹角∠1比∠2大,原因是__。
②分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
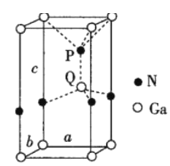
(6)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。若该晶体密度为dg·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=___nm(写出代数式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态锑(Sb)原子价电子排布的轨道式为____。[H2F]+[SbF6]—(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______、_________。
(2)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 配位键 E 范德华力
(3)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ_________g·cm-3。
,该晶体的密度ρ_________g·cm-3。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们已研发出硅负极锂离子电池,在相同体积中,硅负极电池容量比石墨碳电池容量提升25%,反应原理为5LiMn2O4+Si![]() 5Li0.12Mn2O4+Li4.4Si,LiPF6纯液体作电解质,下列有关说法正确的是( )
5Li0.12Mn2O4+Li4.4Si,LiPF6纯液体作电解质,下列有关说法正确的是( )
A.放电时的负极反应为Li﹣e﹣=Li+
B.若用该电池电解水,阴极生成3.52gO2,则该电池负极质量减少0.77g
C.锂离子电池充电时的阴极反应为Si+4.4e-+4.4Li+=Li4.4Si
D.放电时电解质LiPF6水溶液中的Li+移向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述不正确的是
A.分子式为C4H8O2的酯有4种结构
B.主链含5个碳原子,有甲基、乙基2个支链的烷烃有3种
C.丙烯分子中最多有7个原子共平面
D.乙烯和溴的四氯化碳溶液反应生成1,2二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法中正确的是( )
①该化合物仅含碳、氢两种元素 ②该化合物中碳、氢原子个数比为1∶4
③无法确定该化合物是否含有氧元素 ④该化合物中一定含有氧元素
A. ①②B. ②④C. ③④D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com