
Ⅰ、一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH>0。
FeO(s)+CO(g) ΔH>0。
(1)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强
C.充入一定量氮气 D.再加入一些铁粉
(2)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,使CO2的浓度成为原来的2倍,则CO2的转化率将 (填“增大”、“减小”或“不变”)。
Ⅱ、在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)  CO(g)+H2(g),试分析和回答下列问题:
CO(g)+H2(g),试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
(2)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其他条件不变),则容器内气体的平均相对分子质量将 (填写“不变”、“变小”或“变大”)。
Ⅰ、(1)A (2)不变 Ⅱ、(1)B、D (2)变大
【解析】解答该题要注意以下三点:
(1)根据CO与CO2的浓度比值关系得出平衡移动的方向,然后再进行判断。
(2)增大反应物的浓度,反应物的转化率不一定减小;转化率等于转化浓度比起始浓度。
(3)气体的平均相对分子质量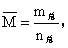 其变化与m总、n总均有关。
其变化与m总、n总均有关。
Ⅰ、(1)使平衡时c(CO)/c(CO2)增大,则需要使平衡向正反应方向移动,CO2的浓度减小,CO的浓度增大, 比值增大。反应为吸热反应,升高温度平衡向正反应方向进行,A对;反应前后气体的物质的量不变,增大压强平衡不移动,B错;充入N2对平衡没有影响,C错;铁粉的量的多少对平衡没有影响,D错。
(2)增大CO2的浓度,反应物中只有CO2为气体,且反应前后气体体积相等。相当于增大压强,平衡不发生移动,CO2的转化率不变。
Ⅱ、(1)因为在恒压容器中进行,压强一直不变,A错;当v正(CO)=v逆(H2O)时,反应达到平衡,B对;任何时刻生成的CO与H2物质的量都相等,C错;1 mol H—H键断裂说明有1 mol H2反应,断裂2 mol H—O键说明有1 mol H2O反应,反应达到平衡,D对。
(2)原平衡状态中CO、H2的平均相对分子质量为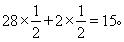 加压时平衡逆向移动,H2O(g)(相对分子质量为18)的含量增大,混合气体的平均相对分子质量增大。
加压时平衡逆向移动,H2O(g)(相对分子质量为18)的含量增大,混合气体的平均相对分子质量增大。


科目:高中化学 来源:2014年化学高考总复习课时演练3-4金属材料用途 金属矿物利用练习卷(解析版) 题型:选择题
在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3,铜粉可溶解的是( )
A.①② B.②④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-3盐类的水解练习卷(解析版) 题型:选择题
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O HCOO-+H3O+
HCOO-+H3O+
B.CO2+H2O HCO3-+H+
HCO3-+H+
C.CO32-+H2O HCO3-+OH-
HCO3-+OH-
D.HS-+H2O S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-1弱电解质的电离练习卷(解析版) 题型:填空题
(1)将等质量的Zn粉分别投入:a:10 mL 0.1 mol·L-1 HCl和
b:10 mL 0.1 mol·L-1醋酸中。(填“>”、“=”或“<”)
①若Zn不足量,则反应速率a b,
②若Zn过量,产生H2的量a b。
(2)将等质量的Zn粉分别投入pH=1,体积均为10 mL的a:盐酸b:醋酸中
①若Zn不足量,则起始反应速率a b,
②若Zn过量,产生H2的量a b。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-1弱电解质的电离练习卷(解析版) 题型:选择题
相同体积,相同PH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )

查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 7-2化学平衡状态化学平衡移动练习卷(解析版) 题型:选择题
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g) 2C(g) ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
2C(g) ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )


查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 7-1化学反应速率及影响因素练习卷(解析版) 题型:实验题
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂:1.00 mol·L-1 HNO3、2.00 mol·L-1 HNO3,细颗粒大理石、粗颗粒大理石,35 ℃水浴。
(1)他们能完成哪些因素对速率影响的探究?
____________________________________________________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:

(3)整个实验中应控制的不变量是硝酸溶液体积和 。
(4)该实验小组用如图实验装置进行实验。

①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有 。
②干燥管中应放置的试剂是 。
A.碱石灰 B.无水CaCl2
C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率 (填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 6化学反应与能量练习卷(解析版) 题型:选择题
25 ℃、101 kPa下:
①2Na(s)+1/2O2(g)=Na2O(s) ΔH1=-414 kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) ΔH2=-511 kJ·mol-1
下列说法正确的是( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa 下,Na2O2(s)+2Na(s)=2Na2O(s) ΔH =-317 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 5-1原子结构原子核外电子排布练习卷(解析版) 题型:选择题
下列有关化学用语的表示正确的是( )
A. S2-的结构示意图为:
B.质子数为53、中子数为78的碘原子:13153I
C. F-的结构示意图:
D.由含有2个中子的氢原子与10个中子的氧原子形成的水分子的化学式可表示为:21H2188O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com