
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。下列说法正确的是

A. Y、Z、W处于同一周期
B. X、Y、Z、W的原子序数递增
C. X、W可形成化学式为XW的离子化合物
D. 简单离子半径是Z小于W
科目:高中化学 来源: 题型:
【题目】锌粉与碘粉混和均匀置于平底烧瓶中,向其中滴几滴水,看见有紫红色的蒸气,该蒸气是__,产生该气体的现象叫做___,说明锌粉与碘的反应为__(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 | 装置 |
A | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: N>C>Si |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡益均可以生成白色沉淀 | |
D | 浓硝酸 | 铝片 | 氢氧化钠溶液 | 浓硝酸具有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E,F,G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如表所示.
元素 | 原子结构特征或有关物质的性质 |
A | 原子的最外层电子数是其内层电子数的2倍 |
B | 其单质是空气中含量最多的物质 |
C | 原子的最外层电子数是其电子层数的4倍 |
D | 位于第ⅡA族,其原子半径比E的大 |
E | 是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
F | 原子序数16,其单质在通常状况下为固体 |
G | 原子的最外层电子数比其次外层电子数少1个 |
(1)元素F在元素周期表中的位置是 . 这七种元素中,不属于主族元素的元素的名称是 .
(2)在E,F,G三种元素中,原子半径最小的是(填元素符号).
(3)元素A与G可形成化合物AG4 , 在该化合物中含有的化学键类型为 , 分子的空间结构为 . A与氧元素可形成化合物AO2 , 该化合物分子的电子式为 .
(4)元素B能与氢元素形成化合物BH3 , 在通常状况下,BH3的水溶液呈(填“酸”、“碱”或“中”)性,原因为(用方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为短周期主族元素,其原子序数依次增大。A、B 两元素最高正价和最低负价之和为零。E和A同主族; D、F是地壳中含量最高的非金属元素和金属元素。
(1)写出C元素的元素名称____,其在周期表中的位置_______________。E离子结构示意图为______________;E2D2的电子式______________。
(2)由A、C以原子个数比为5:1组成的一种化合物,其中各原子均达到稳定结构,该化合物中所含化学键类型为______________。
(3)F的最高价氧化物和C 的最高价氧化物对应的水化物反应的离子方程式为______________。
(4)由C、E 组成的一种离子化合物化学式为E3C,该化合物中两种离子的半径大小关系是______>______;该化合物遇水剧烈反应,该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读明代爱国诗人于谦的诗《石灰吟》,回答问题:
千锤万凿出深山,烈火焚烧若等闲.粉身碎骨浑不怕,要留清白在人间
(l)整首诗蕴含着石灰的来源、生产、性质、用途等多种化学事实,诗中所描述的变化共涉及到下列物质:①石灰石(主要成分CaC03)②Ca0③C02④H20⑤Ca(OH)2悬浊液⑥CaC03,其中属于电解质的是______(填序号)
(2)下列工业生产中一般不用石灰石作为原料的是______(填序号)
①用海水为原料生产镁 ②制硅酸盐水泥 ③制普通玻璃 ④制漂白粉⑤制陶瓷
(3)零食包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰,生石灰属于_____氧化物(填“酸性”或“碱性”),用方程式说明你的理由________.
(4)某兴趣小组同学对碳酸钙的制备进行了以下探究,该组同学使用大理石(含少量的Fe203杂质)等物质制备碳酸钙的实验流程如图:

溶解大理石时,用硝酸而不用硫酸的原因是____,“滤液A”中除H+离子外,还含有的阳离子是_____;检验该阳离予的实验操作是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲苯为原料可以合成某种食用香料(有机物G)和某种治疗肺结核药物的有效成分(有机物PAS﹣Na)的路线如下: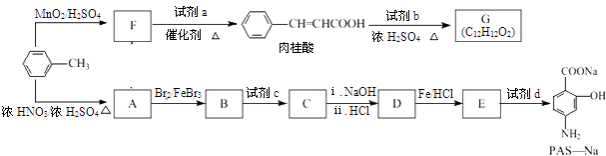
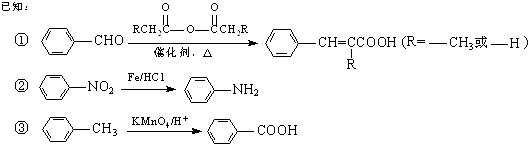
回答下列问题:
(1)由B生成C的反应类型是 .
(2)肉桂酸中含氧官能团的名称是 .
(3)写出由A生成B的化学方程式: .
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式: .
(5)当试剂d过量时,可以选用的试剂d是(填字母序号).a.NaOH b.Na2CO3 c.NaHCO3
(6)写出C与NaOH反应的化学方程式: .
(7)在肉桂酸分子中碳碳双键催化加氢后得到化合物X(分子式为C9H10O2),X有多种同分异构体,符合下列条件的有种.a.苯环上有两个取代基; b.能发生银镜反应; c.与Na作用有H2产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某恒容密闭容器中含有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如图所示:

(1)表示NO2浓度变化的曲线是_____,写出相应的化学方程式:______________。
(2)从反应开始至达到平衡的过程中,用N2O4表示的反应速率v(N2O4)=_________,a、b两点对应状态中,曲线x代表的物质的反应速率相对大小为:v(a)____v(b)。
(3)若平衡后改变温度,容器中气体平均摩尔质量变大,则反应向生成_____(填“NO2”或“N2O4”)的方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com