
����Ŀ���Լױ�Ϊԭ�Ͽ��Ժϳ�ij��ʳ�����ϣ��л���G����ij�����Ʒν��ҩ�����Ч�ɷ֣��л���PAS��Na����·�����£�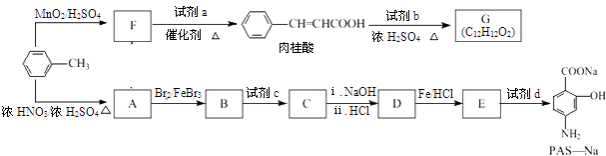
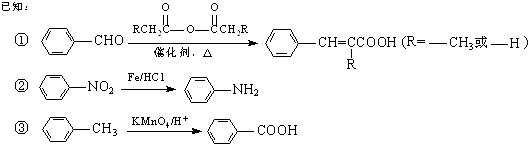
�ش��������⣺
��1����B����C�ķ�Ӧ������ ��
��2��������к��������ŵ������� ��
��3��д����A����B�Ļ�ѧ����ʽ�� ��
��4������ͼ��ʾ�Լ�b����Է�������Ϊ58�������в���������Ϊ��״�ṹ��д����������Լ�b����G�Ļ�ѧ����ʽ�� ��
��5�����Լ�d����ʱ������ѡ�õ��Լ�d��������ĸ��ţ���a��NaOH b��Na2CO3 c��NaHCO3
��6��д��C��NaOH��Ӧ�Ļ�ѧ����ʽ�� ��
��7��������������̼̼˫���������õ�������X������ʽΪC9H10O2����X�ж���ͬ���칹�壬�����������������֣�a��������������ȡ������ b���ܷ���������Ӧ�� c����Na������H2������
���𰸡�
��1��������Ӧ
��2���Ȼ�
��3��
��4��![]()
��5��c
��6��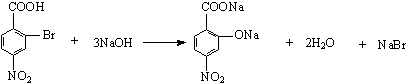
��7��18
���������⣺�ɷ�Ӧ�����̿ɿ�����F��������ᷢ����Ϣ�ٵķ�Ӧ�����Կ���֪ ![]() ��MnO2/H2SO4����������ΪF
��MnO2/H2SO4����������ΪF ![]() ��
�� ![]() ��H3COOOCCH3��Ӧ��
��H3COOOCCH3��Ӧ�� ![]() ������
������ ![]() ��G�ķ���ʽ��֪��
��G�ķ���ʽ��֪�� ![]() ���Լ�b��Ӧ����G������ͼ��ʾ�Լ�b����Է�������Ϊ58�������в���������Ϊ��״�ṹ������ж�bΪ��ϩ����
���Լ�b��Ӧ����G������ͼ��ʾ�Լ�b����Է�������Ϊ58�������в���������Ϊ��״�ṹ������ж�bΪ��ϩ���� ![]() �ͱ�ϩ��������GΪ
�ͱ�ϩ��������GΪ ![]() ��
�� ![]() ��Ũ���ᷢ��������Ӧ����A������PAS��Na�Ľṹ��ʽ���ƶ�AΪ
��Ũ���ᷢ��������Ӧ����A������PAS��Na�Ľṹ��ʽ���ƶ�AΪ ![]() ��
�� ![]() ��Br2±���ڼ���λ����Br��BΪ
��Br2±���ڼ���λ����Br��BΪ 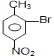 ��B�����Ը������������CΪ
��B�����Ը������������CΪ 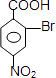 �����Լ�cΪ���Ը��������Һ����������Ϊ�Ȼ���C��C����������ˮ������ữ��DΪ
�����Լ�cΪ���Ը��������Һ����������Ϊ�Ȼ���C��C����������ˮ������ữ��DΪ 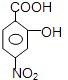 ��D����������ԭΪ������EΪ
��D����������ԭΪ������EΪ 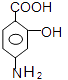 ��E��̼�����Ʒ�Ӧ��PAS��Na����1����������ķ�����֪����B����C�ķ�Ӧ������������Ӧ�����Դ��ǣ�������Ӧ�� ��2�����������Ľṹ��ʽ��֪�����к��������ŵ��������Ȼ������Դ��ǣ��Ȼ��� ��3����A����B�Ļ�ѧ����ʽΪ
��E��̼�����Ʒ�Ӧ��PAS��Na����1����������ķ�����֪����B����C�ķ�Ӧ������������Ӧ�����Դ��ǣ�������Ӧ�� ��2�����������Ľṹ��ʽ��֪�����к��������ŵ��������Ȼ������Դ��ǣ��Ȼ��� ��3����A����B�Ļ�ѧ����ʽΪ 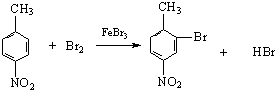 �����Դ��ǣ�
�����Դ��ǣ� 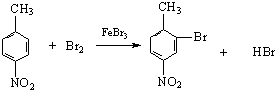 ����4��GΪ
����4��GΪ ![]() ��bΪ��ϩ������������Լ�b����G�Ļ�ѧ����ʽΪ
��bΪ��ϩ������������Լ�b����G�Ļ�ѧ����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����5���Լ�d���Խ��Ȼ�ת��Ϊ�����Σ������ܺͷ��ǻ���Ӧ��һ����NaHCO3 �� ��ѡ��c����6���������Ϸ�����CΪ
����5���Լ�d���Խ��Ȼ�ת��Ϊ�����Σ������ܺͷ��ǻ���Ӧ��һ����NaHCO3 �� ��ѡ��c����6���������Ϸ�����CΪ  ��C�к����Ȼ�����ԭ�ӣ����Ժ�����������Һˮ�⡢�к͵ķ���ʽΪ��
��C�к����Ȼ�����ԭ�ӣ����Ժ�����������Һˮ�⡢�к͵ķ���ʽΪ�� 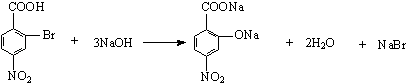 �����Դ��ǣ�
�����Դ��ǣ�  ����7��X�ķ���ʽΪC9H10O2 �� X��ͬ���칹�壬������������a��������������ȡ������b���ܷ���������Ӧ��˵����ȩ����c����Na������H2������˵���Щ�OH�ṹ������������X���칹������DZ��������Щ�OH����CH2CH2CHO��OH����CH��CH3��CHO��CH3����CH��OH��CHO��CHO����CH2CH2OH��CH2CHO����CH2OH��CHO����CH��CH3��OH��ÿ�ֶ����ڼ�����ֽṹ�����Թ���18�֣�
����7��X�ķ���ʽΪC9H10O2 �� X��ͬ���칹�壬������������a��������������ȡ������b���ܷ���������Ӧ��˵����ȩ����c����Na������H2������˵���Щ�OH�ṹ������������X���칹������DZ��������Щ�OH����CH2CH2CHO��OH����CH��CH3��CHO��CH3����CH��OH��CHO��CHO����CH2CH2OH��CH2CHO����CH2OH��CHO����CH��CH3��OH��ÿ�ֶ����ڼ�����ֽṹ�����Թ���18�֣�
���Դ��ǣ�18��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʻ�Ϻ�����ѧ��Ӧ,���������ӷ�Ӧ��( )
A.NaOH��Һ��K2SO4��Һ���B.пƬͶ��ϡ������
C.����KClO3��MnO2����������O2D.H2��O2��Ӧ����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W�����ֳ����Ķ���������Ԫ�أ���ԭ�Ӱ뾶��ԭ�������ı仯��ͼ��ʾ����֪Y��Z����Ԫ�صĵ����ǿ�������Ҫ�ɷ֣�Wԭ�ӵ�������������Neԭ�ӵ��������������1������˵����ȷ����

A. Y��Z��W����ͬһ����
B. X��Y��Z��W��ԭ����������
C. X��W���γɻ�ѧʽΪXW�����ӻ�����
D. �����Ӱ뾶��ZС��W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣���Ա��еĢ١������Ԫ�أ���Ԫ�ط��Ż�ѧʽ�ش�������⣺

(l)����ЩԪ���У���ѧ���������ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ______.
(2)�õ���ʽ��ʾ������γɻ�����Ĺ���______.��
(3)��ЩԪ�ص�����������Ӧ��ˮ�����У�������ǿ����______. ���ڡ��ܵ�����������Ӧˮ�������Һ��Ӧ�����ӷ���ʽΪ��______.
(4)�٢ڢۢ�����Ԫ�صļ����Ӱ뾶�ɴ�С��˳����______.�������ӷ��ź͡�>����ʾ����
(5)�٢ݢ�����Ԫ�صĵ��ʷе��ɸߵ��͵�˳����______.���û�ѧʽ�͡�>����ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������е����б仯�����������仯���� ���� ����
A. ֲ��Ĺ������ B. ȼ���̻� C. ����ȼ�� D. ���ݷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Լռ����������71%������ʮ�־�Ŀ���DZ����ͨ����ˮ���ۺ����ÿɻ���������ʹ�����ʹ�ã�
��1����ˮ���Ƶõ��Ȼ��Ƴ�ʳ���⣬��������ҵԭ�ϣ�����ͨ����NaCI��CO2��NH3Ϊԭ����ȡ�����д����һ����ȡNaHCO3�Ļ�ѧ����ʽ�� ��
��2����ҵ����Ũ����ˮΪԭ����ȡ��IJ���������ͼ1��
��֪��Br2�����³�Һ̬���ӷ����ж���2Br2+3CO32��=5Br��+BrO3��+3CO2 ��
��ͨ����������������ѻ�ú�Br2����Һ��Ϊ�λ��辭�����������ա��ữ�����»�ú�Br2����Һ��ԭ���� ��
�ڷ�Ӧ��2�з�����Ӧ�����ӷ���ʽΪ ��
������������ͨ��ˮ�������ȣ������¶���90�����ҽ��������ԭ���� ��
��3������±������ȴ������±�����Ҫ�ɷ���MgCI2 �� �������Fe2+��Fe3+��Mn2+�����ӣ���±��Ϊԭ���Ƶ�þ�Ĺ���������ͼ2�����ֲ�������������ȥ����
�����������������pH
���� | ��ʼ���� | ������ȫ |
Fe��OH��3 | 2.7 | 3.7 |
Fe��OH��2 | 7.6 | 9.6 |
Mn��OH��2 | 8.3 | 9.8 |
Mg��OH��2 | 9.6 | 11.1 |
����NaClO����Fe2+�õ�Fe��OH��3���������ӷ�Ӧ����ʽ�� ��
�ڲ��������HCl�������м��Ƚ��У����û�ѧƽ���ƶ�ԭ������ԭ�� ��
��NaClO���ܳ�ȥ��±�е�CO��NH2��2 �� �����κ��ܲ������ѭ�������ʣ���ȥ0.1molCO��NH2��2ʱ����NaCIOg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4mol SO2��2molO2����4L���ܱ������У���һ�������·�Ӧ�ﵽƽ�⣺2SO2+O22SO3���ƽ��ʱ������ܵ����ʵ���Ϊ5mol����
��1��ƽ��ʱ�����ʵ�Ũ�ȣ�
��2��ƽ��ʱSO2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧѧϰ���о��벻��Ԫ�����ڱ����±�ΪԪ�����ڱ���һ���֣����Т�-��ֱ����һ��Ԫ�ء��ش��������⣺
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |
1 | �� | |||||||
2 | �� | �� | �� | �� | �� | �� | ||
3 | �� | �� | �� |
��1������Ԫ���У���һ��Ԫ������Ȼ�����γɵ�����������࣬��Ԫ�������ڱ��е�λ����_______��
��2���ࡢ�ᡢ��Ԫ�ص����Ӱ뾶�ɴ�С��˳��Ϊ________________(�����ӷ��ű�ʾ)��
��3��д���ɢ١��ޡ�������Ԫ���γɵ�һ�����ӻ�����ĵ���ʽ__________________��
��4������Ԫ������һ��Ԫ�ص���������������ﶼ�����ԣ������Ԫ�ص�ԭ�ӽṹʾ��ͼ______________�����������£���Ԫ�صĵ����������ܷ�����Ӧ���˷�Ӧ������Ұ�⺸�Ӹֹ죬��÷�Ӧ�������仯����ͼ__________________��ʾ������ס����ҡ���
��5��֪W+X��Y+Z����W��X��Y��Z�ֱ����ɢ١��ݡ�������Ԫ���е������γɵ�10�������ӣ�д������ƽ������Ӧʽ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����±�������Ժ�ijЩ������Ӧ�������������л���������������뺬�ʻ��� ![]() ���Ļ����ﷴӦ���ɴ���
���Ļ����ﷴӦ���ɴ��� ![]()
�ڱ���AlCl3����������±�������·�Ӧ��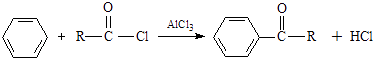
�л���E�ɾ�����·�ߺϳɣ�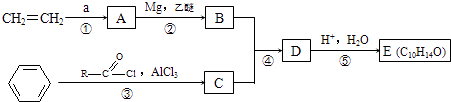
E���Ʒ�Ӧ�ų���������ͨ�����ܱ�����������ȩ��ͪ��E�����Ṳ�ȵ�һ���¶ȿɵõ�F��G��F����������̼ԭ�Ӿ��ɹ�����ͬһƽ���ϣ���Gȴ���ɣ��ش��������⣺
��1��E��F��G�Ľṹ��ʽ�ֱ��ǣ�E �� F �� G ��
��2��д�����л�ѧ��Ӧ����ʽ���� �� �� ��
��3��E����E��ͬ���칹������E��ͬһ�����E�䲻�ܴ��ʻ�������ֱ�Ӽ��ԭ�õ�����E����ܵĽṹ��ʽΪ����E����Ũ���Ṳ�Ȳ��ܵõ�̼�������ϩ������E����ܵĽṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com