
【题目】Ⅰ.查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。
(1)已知高锰酸钾能氧化草酸.反应如下(部分产物和生成物未写):MnO![]() +H2C2O4→Mn2++CO2↑。若把该反应设计成一原电池,则正极的电极反应式为___。
+H2C2O4→Mn2++CO2↑。若把该反应设计成一原电池,则正极的电极反应式为___。
(2)某同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL0.2molL-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,则其中含碳元素的粒子中物质的量浓度最小的微粒化学式为___。
Ⅱ.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种。
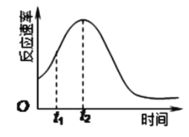
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
(3)猜想Ⅱ可能是:___。
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
试管A | 试管B | |
加入试剂 | 2mL0.1mol/LH2C2O4溶液、1mL0.05mol/L酸性KMnO4 | 2mL0.1mol/LH2C2O4溶液、1mL0.05mol/L酸性KMnO4,少量___固体(填物质名称) |
实验现象 (褪色时间) | 褪色时间10min | 褪色时间___10min (选填“<”“>”或“=”) |
结论 | 猜想Ⅱ正确 | |
Ⅲ.为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0g试样,加水溶解,配成250mL试样溶液。
②用酸式滴定管量取25.00mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500mol/LNaOH溶液滴定,消耗NaOH溶液20.00mL。
③再取25.00mL试样溶液放入另一锥形瓶中,用0.1000mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00mL。
回答下列问题:
(5)步骤③中判断滴定终点的方法是___。
(6)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得H2C2O4·2H2O的质量分数___。(填“偏大”、“偏小”或“无影响”)
【答案】MnO![]() +5e-+8H+=Mn2++4H2O H2C2O4 生成的Mn2+对该反应有催化作用,加快反应速率 硫酸锰 < 溶液由无色变为浅红色(或紫色、紫红色),且半分钟内不褪色 偏小
+5e-+8H+=Mn2++4H2O H2C2O4 生成的Mn2+对该反应有催化作用,加快反应速率 硫酸锰 < 溶液由无色变为浅红色(或紫色、紫红色),且半分钟内不褪色 偏小
【解析】
(1)原电池的正极发生还原反应,高锰酸根离子中锰元素的化合价降低,发生还原反应,由此分析解答;
(2)H2C2O42H2O物质的量0.02mol,与 NaOH恰好完全反应生成草酸氢钠,混合后溶液呈酸性,说明草酸氢根离子电离程度大于水解程度,结合电荷守恒判断离子浓度大小;
Ⅱ.(3)猜想II是认为生成的Mn2+在反应中起到催化剂的作用,故应补充MnSO4,通过测量溶液褪色的时间来验证猜想;
(4)要通过对比实验来验证猜想Ⅱ,则实验B和实验A的加入试剂除了MnSO4固体不同,其他均应相同,据此分析;
Ⅲ.(5)原溶液无色,KMnO4为紫红色,当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色且半分钟颜色不变;
(6)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,导致标准溶液氢氧化钠的体积增大,据此回答问题。
(1)已知高锰酸钾能氧化草酸反应如下:MnO![]() +H2C2O4→Mn2++CO2↑。若把该反应设计成一原电池,根据原电池原理,正极发生还原反应,化合价降低,则正极的电极反应式为MnO
+H2C2O4→Mn2++CO2↑。若把该反应设计成一原电池,根据原电池原理,正极发生还原反应,化合价降低,则正极的电极反应式为MnO![]() +5e-+8H+=Mn2++4H2O。
+5e-+8H+=Mn2++4H2O。
(2)某同学将2.52g草酸晶体(H2C2O42H2O)即0.02mol,加入到100mL0.2molL-1的NaOH溶液中充分反应,二者恰好完全反应生成草酸氢钠,混合后溶液呈酸性,说明草酸氢根离子电离程度大于水解程度,水电离生成氢离子,结合电荷守恒判断离子浓度大小为Na+>HC2O4->H+>C2O4->H2C2O4>OH-,则其中含碳元素的粒子中物质的量浓度最小的微粒化学式为H2C2O4。
Ⅱ.(3)根据反应速率的影响因素知,可能是反应生成的Mn2+起了催化作用,从而使反应速率加快;。
(4)猜想Ⅱ成立,即Mn2+在反应中起到催化剂的作用,从而加快了反应速率,所以和设计方案进行实验,要进行一组对比实验,一支试管A中仅仅2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,另外一支试管B中加入2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s),根据溶液褪色的快慢来判断Mn2+在反应中是否起到催化剂的作用,若猜想Ⅱ成立,褪色时间小于10min。
试管A | 试管B | |
加入试剂 | 2mL0.1mol/LH2C2O4溶液、1mL0.05mol/L酸性KMnO4 | 2mL0.1mol/LH2C2O4溶液、1mL0.05mol/L酸性KMnO4,少量硫酸锰固体 |
实验现象 (褪色时间) | 褪色时间10min | 褪色时间<10min |
结论 | ||
Ⅲ. (5)原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变,滴定到终点。
(6)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,导致标准溶液氢氧化钠的体积增大,测定KHC2O4的含量增大,草酸含量减小。


科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
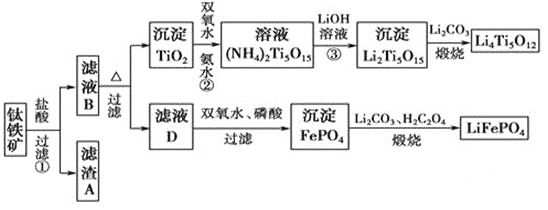
⑴钛铁矿在预处理时需要进行粉碎,其原因是__________________________________。
⑵过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________________________。
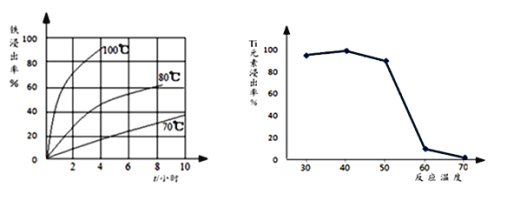
⑶过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是_______________________。
⑷写出由滤液D生成FePO4的离子方程式_____________________________________________
⑸由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
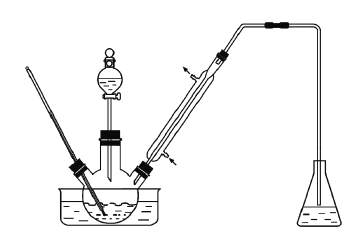
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是________,锥形瓶中的溶液应为________。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为_________。
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_________。
(5)步骤4中采用减压蒸馏技术,是为了防止_____。
附表 相关物质的沸点(101kPa)
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓硫酸和乙醇混合加热制取乙烯,下列说法正确的个数是( )
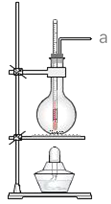
①浓硫酸只作催化剂
②在反应容器中放入几片碎瓷片防止混合液暴沸
③反应温度缓慢上升至170℃
④用排水法或向下排气法收集乙烯
⑤圆底烧瓶中装的是4mL乙醇和12mL3mol/LH2SO4混合液
⑥温度计应插入反应溶液液面下,以便控制温度
⑦反应完毕后先熄灭酒精灯,再从水中取出导管
⑧该反应类型属于取代反应
⑨若a口出来的气体使溴水褪色,说明有乙烯生成
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应历程如下图所示,下列说法不正确的是( )
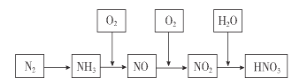
A. 氨可用作制冷剂
B. 铵态氮肥一般不能与碱性化肥共同使用
C. 硝酸可用于制化肥、农药、炸药、染料、盐类等
D. 某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表陈述Ⅰ、Ⅱ均正确,且两者在反应原理上相似的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 将 |
|
B |
|
|
C | 玻璃试剂瓶可用于盛放氢氟酸 | 石英坩埚不能用于熔化NaOH |
D |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应 N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJB. 一定等于92.0 kJ
C. 一定小于92.0 kJD. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com