
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的![]() ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A、B、C三种元素的第一电离能由小到大的顺序为____________ (用元素符号表示);A、B、C三种元素的简单氢化物的稳定性顺序为:_______(用化学式表示)。
(2)D元素原子的价电子排布式是________,估计D元素的第2次电离能飞跃数据将发生在失去第______个电子时。
(3)C元素的电子排布图为______。E的外围电子排布为_______ ,E原子的结构示意图为_______。
(4)F元素位于元素周期表的_______区,其基态原子的电子排布式为________。
(5)G元素可能的性质________。
A 其单质可作为半导体材料 B 其电负性大于磷
C 其原子半径大于锗 D 其第一电离能小于硒
(6)电离能比较:I1(Mg)________I1(Al)(填“>”或“<”),其原因______。
【答案】O<N<F NH3<H2O<HF 3s2 3 ![]() 3d64s2
3d64s2 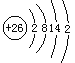 ds 1s22s22p63s23p63d104s1或[Ar]3d104s1 A > 镁原子的3p轨道处于全空,比较稳定,而铝原子3p轨道只有一个电子,不稳定
ds 1s22s22p63s23p63d104s1或[Ar]3d104s1 A > 镁原子的3p轨道处于全空,比较稳定,而铝原子3p轨道只有一个电子,不稳定
【解析】
A元素的价电子构型为nsnnpn+1,n=2,A为N元素,C元素为最活泼的非金属元素,C为F元素,则B为O元素,D元素核外有三个电子层,最外层电子数是核外电子总数的![]() ,应为Mg元素,E元素正三价离子的3d轨道为半充满状态,则原子序数为26,为Fe元素,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,为Cu元素,G元素与A元素位于同一主族,其某种氧化物有剧毒,为As元素,据此分析答题。
,应为Mg元素,E元素正三价离子的3d轨道为半充满状态,则原子序数为26,为Fe元素,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,为Cu元素,G元素与A元素位于同一主族,其某种氧化物有剧毒,为As元素,据此分析答题。
(1)A为N元素,B为O元素,C为F元素,同周期元素第一电离能逐渐增大,N原子最外层为半充满状态,性质稳定,难以失去电子,第一电离能大于O元素,第一电离能由小到大的顺序为O<N<F;非金属性越强,对应简单气态氢化物的稳定性越强,三种元素的简单氢化物的稳定性顺序为:NH3<H2O<HF;
(2)D为Mg元素,最外层电子数为2,价电子排布式为3s2,失去两个电子后最外层电子排布为2p6,属于全满稳定状态,因此估计Mg元素的第2次电离能飞跃数据将发生在失去第3个电子时;
(3)C为F元素,电子排布图为![]() ,E为Fe元素,铁原子的核外电子排布式为:1s22s22p63s23p63d64s2,外围电子排布为3d64s2,E原子的结构示意图为
,E为Fe元素,铁原子的核外电子排布式为:1s22s22p63s23p63d64s2,外围电子排布为3d64s2,E原子的结构示意图为 ;
;
(4)F为Cu,位于周期表ds区,其基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
(5)A.G为As元素,与Si位于周期表对角线位置,其单质可作为半导体材料,故A正确;
B.同主族元素从上往下,电负性逐渐减弱,P和As处于同主族,所以P电负性大于As,故B错误;
C.As和锗元素位于同一周期,且原子序数大于锗,同周期原子半径随着原子序数增大,原子半径变小,As的原子半径小于锗,故C错误;
D.同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素最外层电子排布处于半充满,第一电离能大于相邻元素,所以As、Se两种元素的第一电离能的大小顺序是:As>Se,故D错误;
答案选A;
(6)元素D为Mg,活泼性Mg>Al,I1(Mg)>I1(Al),因为Mg的3p轨道处于全空,比较稳定,而Al的3p轨道只有一个电子,不稳定,故活泼性Mg>Al,而第一电离能则是I1(Mg)>I1(Al)。


科目:高中化学 来源: 题型:
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
则反应IV:CO2(g)+H2(g)![]() HCOOH(g)的△H =____________kJmol-1。
HCOOH(g)的△H =____________kJmol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→MHCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[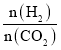 ]的变化如图所示:
]的变化如图所示:
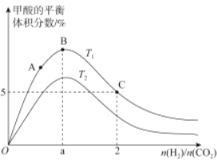
①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. SiO2硬度大的原因与Si、O原子之间的成键方式及排列方式有关
B. 乙醇沸点高于二甲醚的原因与分子间作用力大小有关
C. 冰醋酸溶于水时只破坏分子间作用力
D. MgO熔点高达![]() 是因为其中的离子键较难被破坏
是因为其中的离子键较难被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g)![]() SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是
SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是
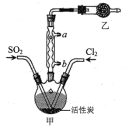
A.乙装置中盛放的试剂是P2O5,防止水蒸气进入装置中
B.装置甲应置于冰水浴中,目的是提高SO2Cl2产率
C.反应结束后,分离甲中混合物的实验操作是蒸馏
D.SO2、Cl2均可使品红试液褪色,原理不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常为+3价,这些化合物在研究和生产中有许多重要用途。请回答下列问题。
(1)镓元素(Ga)的原子序数为__________,其外围电子排布式__________。
(2)由第二周期元素组成的与BCl3互为等电子体的阴离子为________。 硼元素具有缺电子性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]—。不考虑空间构型,[B(OH)4]—中原子的成键方式用结构简式表示为______________。1 mol [B(OH)4]—中σ键的数目为________。
(3)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因______________。
(4)磷化铝熔点为2000℃,空间结构与金刚石相似,磷化铝晶胞结构如图所示。
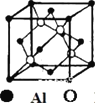
①磷化铝晶体中磷与铝微粒间的作用力为__________。
②磷化铝晶体的密度为ρ g·cm-3,用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为__________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与处理方法对应的反应方程式不正确的是
A.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
B.用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+y/4)O2![]() xCO2+y/2H2O
xCO2+y/2H2O
C.用催化法处理汽车尾气中的CO和NO:CO+NO![]() C+NO2
C+NO2
D.用Na2S形成沉淀去除废水中的Hg2+:Hg2++S2-=HgS↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成一种新化合物(如图所示)。

其中W、X、Y、Z为同周期元素,W是所在周期中第一电离能最小的元素,Y元素基态原子的未成对电子数等于其电子层数,Z元素的原子核外最外层电子数是X核外电子数的一半。
回答下列问题:
(1)W、X、Y、Z原子半径由大到小的顺序为__(用对应的元素符号表示)。
(2)Z的核外电子排布式为__。
(3)基态X原子价电子轨道表示式为__。
(4)W元素基态原子核外电子有__种运动状态,其中电子占据能量最高的原子轨道符号表示为__。
(5)X的电负性__(填“大于”或“小于”)Y,原因是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com