
����Ŀ��X��Y��Z��W�������ֶ�����Ԫ�أ�
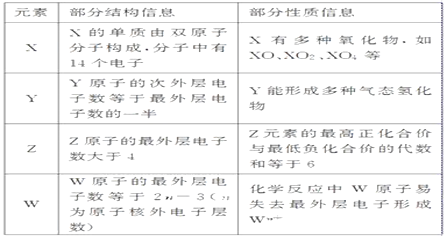
�й����ǵIJ��ֽṹ��Ϣ��������Ϣ�����ʾ���밴Ҫ��ش��������⣺
(1)Z��Ԫ�����ڱ��е�λ����________________��
(2)X��Y����̬�⻯����ȶ�����ǿ������˳����______________(�û�ѧʽ��ʾ)��
(3)X��Y��Z����Ԫ�ص�����������Ӧˮ�����������ǿ������˳����____________________(�û�ѧʽ��ʾ)��
(4)ʵ������X����̬�⻯���ˮ��Һ��ȡW����������ķ�����______________________(�����ӷ���ʽ��ʾ)��
(5)д��Z�ĵ������������Ļ������ͨ��ˮ����������Ӧ�����ӷ���ʽ__________________��
���𰸡� �������ڢ�A�� NH3>CH4 HClO4>HNO3>H2CO3 Al3����3NH3��H2O===Al(OH)3����3NH![]() Cl2��SO2��2H2O===4H����2Cl����SO
Cl2��SO2��2H2O===4H����2Cl����SO![]()
��������X��Y��Z��W�Ƕ����ڵ�����Ԫ��,X�ĵ�����˫ԭ�ӷ��ӹ���,��������14������,��������Ϊ7,X�ж���������,��XO��XO2��X2O4��,����XΪNԪ����Yԭ�ӵĴ�������������������������һ��,Y���γɶ�����̬�⻯��,��YΪCԪ���� Zԭ�ӵ���������������4,���ڷǽ���Ԫ��,ZԪ�ص���������ϼ���������ϼ۴����͵���6,�����Ϊ+7��,ΪClԪ����Wԭ�ӵ���������������![]() Ϊԭ�Ӻ�����Ӳ���),��ѧ��Ӧ��Wԭ����ʧȥ���������γ�
Ϊԭ�Ӻ�����Ӳ���),��ѧ��Ӧ��Wԭ����ʧȥ���������γ�![]() ,
,![]() ����,��WΪAl��
����,��WΪAl��
(1) Cl�ĺ˵����Ϊ17����Ԫ�����ڱ��е�λ���ǵ������ڢ�A�壻��ȷ�𰸣��������ڢ�A�塣
(2) X��Y����̬�⻯��ֱ�Ϊ��NH3��CH4��ͬһ���ڣ������ҷǽ�������ǿ���⻯���ȶ�����ǿ������ȶ���NH3>CH4����ȷ�𰸣� NH3>CH4��
(3)X��Y��Z����Ԫ�ص�����������Ӧˮ����ֱ�ΪHNO3��H2CO3��HClO4��Ԫ�صķǽ���Խǿ������������Ӧˮ��������Խǿ���ǽ����ԣ�Cl>N>C����������HClO4>HNO3>H2CO3����ȷ�𰸣�HClO4>HNO3>H2CO3��
(4) N��̬�⻯���ˮ��ҺΪ��ˮ��ʵ�������Ȼ����Ͱ�ˮ��Ӧ�Ʊ�Al(OH)3�����ӷ���ʽΪ��Al3����3NH3��H2O===Al(OH)3����3NH![]() ����ȷ�𰸣�Al3����3NH3��H2O===Al(OH)3����3NH
����ȷ�𰸣�Al3����3NH3��H2O===Al(OH)3����3NH![]() ��
��
(5)��������ǿ�����ԣ���ˮ��Һ���ܹ��Ѷ�����������Ϊ��������ӣ����ӷ���ʽ��Cl2��SO2��2H2O===4H����2Cl����SO![]() ����ȷ��: Cl2��SO2��2H2O===4H����2Cl����SO
����ȷ��: Cl2��SO2��2H2O===4H����2Cl����SO![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��װ�â��dz��õ������Ʊ������װ�á�װ��B��C��D��E��G��H��������ȡ����������Ư��������֤��װ�á������װ�ú��������Լ��ش��������⣺


ʵ�����ṩ��ҩƷ�У�ͭƬ��������ء� �������̡���ʯ�ҡ�Ũ���ᡢ�������⡢ϡ���ᡢŨ���ᡢ�Ȼ�李�
(1)�����ṩҩƷ��װ�â���������й����⣺
��ʵ�����Ʊ���������ѡ�õ�װ����_________(�����)��ʵ�����ư�����ѡ��Ϊ__________��
��ʵ�����Ʊ�NO��������ӷ���ʽΪ_____________________�ռ�NO����ɲ��õķ�����______________����
�ۼ����װ�������ԵĹ�����___________________________________________��
(2)�����ṩ���Ʊ�װ�ú�װ��B��C��D��E��G��H�����ʵ�����Ʊ����������������������ʵ���֤ʵ�顣
�ٳ����£�������غ�Ũ������Է�����Ӧ����Cl2�Ϳ�����MnCl2,�÷�Ӧ�������Ļ�ѧʽΪ________________����������Ļ�ѧʽΪ_________________����Ӧ�����ӷ���ʽΪ___________________________________��
���Ʊ�������������֤����Ư�����õ��Ǵ��������������������������������˳��Ϊa��d��e��_____________________________________________________��f��
��װ��D�з�����Ӧ�����ӷ���ʽΪ______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӱ��һ��������ռ�������С����Ҫ������
A.���ӵĸ���B.���Ӽ��ƽ������
C.���ӵ�����D.���ӱ����Ĵ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.����ʱ��2NO2��g��![]() 2NO��g��+ O2��g���������������ݼ��㣬��1molNO2�ֽ�ʱ����Ӧ��______������ա��ų�����_____kJ������
2NO��g��+ O2��g���������������ݼ��㣬��1molNO2�ֽ�ʱ����Ӧ��______������ա��ų�����_____kJ������

��.���������У���Na2O2 ��He ��NaOH ��N2 ��MgCl2 ��NH3 ��H2O2 ��Cl2 ��NH4Cl�������ӻ��������_____________���ǹ��ۻ��������_____________�����зǼ��Թ��ۼ���������_____________��Na2O2�ĵ���ʽ��_____________.N2�Ľṹʽ��_____________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z��W��M���ֶ�����Ԫ�أ�����X��Y��Z��Wͬ���ڣ�Z��Mͬ���壻X����M2��������ͬ�ĵ��Ӳ�ṹ�����Ӱ뾶��Z2����W����Y�ĵ��ʾ����۵�ߡ�Ӳ�ȴ���һ����Ҫ�İ뵼����ϡ�������������⣺
��1��MԪ�صļ����ӵĽṹʾ��ͼΪ_______��
��2��Z�����ڱ��е�λ��Ϊ_____����ǽ����Ա�W�ķǽ�����____(�ǿ��������)��
��3��X��Z��W��ԭ�Ӱ뾶�ɴ�С˳��Ϊ_____________(��Ԫ�ط���)��
��4��Y���⻯�ﻯѧʽΪ______�����⻯���л�ѧ������Ϊ________________������Ӽ����������Թ��ۼ����Ǽ��Թ��ۼ�������
��5��W�ĵ�����X������������ˮ���ﷴӦ�����ӷ���ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ��ڿ����о��ú����׳��ֻ���������ǣ� ��
A.ϡH2SO4B.ϡ����C.H2S��ҺD.��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ٱ������������춡���2��������ݼ��飬�������ʵķе㰴�ɵ͵��ߵ�˳�����е��ǣ� ��
A.�٢ۢڢܢ�
B.�ݢܢۢڢ�
C.�٢ڢۢܢ�
D.�ݢ٢ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н��п��淴Ӧ��A��B��Ӧ����C���䷴Ӧ���ʷֱ��æԣ�A�����ԣ�B�����ԣ�C����molL��1s��1����ʾ���Ҧԣ�A�����ԣ�B�����ԣ�C��֮����������ʾ�Ĺ�ϵ���ԣ�B��=3�ԣ�A���� 3�ԣ�C��=2�ԣ�B������˷�Ӧ�ɱ�ʾΪ�� ��
A.2A+3B2C
B.A+3B2C
C.3A+B2C
D.A+BC
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������[��NH4��2Fe��SO4��2]��һ����Ҫ�Ļ���ԭ�ϣ������й�˵����ȷ���ǣ� ��
A.Na+��Fe3+��NO3����Cl2�����ڸ����ʵ���Һ�д�������
B.��0.1mo1/L�����ʵ���Һ�����0.1mo1/LNaOH��Һ�����ɳ��������ʵ�������μ���NaOH��Һ�����ϵ��ͼ��ʾ
C.�����������Fe2+�Ƿ���ʵķ�����������ʵ���Һ�е��뼸��KSCN��Һ���۲���Һ�Ƿ���ɫ
D.������ʵ���Һ��ժ��Ba��OH��2��Һ��ǡ��ʹSO42����ȫ���������ӷ���ʽΪ��Fe2++2SO42��+3Ba2++2OH���T2BaSO4��+Fe��OH��2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com