
【题目】装置Ⅰ、Ⅱ、Ⅲ是常用的三种制备气体的装置。装置B、C、D、E、G、H是用于制取氯气并进行漂白性质验证的装置。请根据装置和所给的试剂回答下列问题:


实验室提供的药品有:铜片、高锰酸钾、 二氧化锰、熟石灰、浓盐酸、过氧化氢、稀硝酸、浓硝酸、氯化铵。
(1)根据提供药品和装置Ⅰ、Ⅱ、Ⅲ完成下列有关问题:
①实验室制备氧气,可选用的装置是_________(填序号)。实验室制氨气所选试为__________。
②实验室制备NO气体的离子方程式为_____________________收集NO气体可采用的方法是______________法。
③检验Ⅲ装置气密性的过程是___________________________________________。
(2)现用提供的制备装置和装置B、C、D、E、G、H来完成实验室制备纯净氯气并进行氯气性质的验证实验。
①常温下,高锰酸钾和浓盐酸可以发生反应生成Cl2和可溶性MnCl2,该反应氧化剂的化学式为________________,氧化产物的化学式为_________________,反应的离子方程式为___________________________________。
②制备纯净氯气并验证能起漂白作用的是次氯酸而不是氯气,从左到右仪器的连接顺序为a→d→e→_____________________________________________________→f。
③装置D中发生反应的离子方程式为______________________________________。
【答案】 Ⅱ、Ⅲ 熟石灰和氯化铵 3Cu+8H++2NO3- = 3Cu2++4H2O+2NO↑ 排水法 将导气管插入水槽的水中,给烧瓶加热,如果导气管口有气泡冒出,冷却后导气管内有一段液柱上升,说明气密性良好;否则漏气 KMnO4 Cl2 2MnO4-+10Cl-+16H+= 2Mn2++5Cl2↑+8H2O →b,c(c,b) →k,l→g,h→i,j Cl2 + 2OH- = Cl-+ ClO-+ H2O
【解析】(1)①实验室利用氯酸钾和二氧化锰加热制备氧气,属于固+固加热制备气体,可选用的装置Ⅱ,也可以用二氧化锰与双氧水反应制备氧气,属于固+液不加热反应制备气体,可选用的装置Ⅲ;实验室氯化铵和熟石灰加热制氨气;正确答案:Ⅱ、Ⅲ;熟石灰和氯化铵。
②实验室用铜和稀硝酸反应制备NO气体,离子方程式为3Cu+8H++2NO3- = 3Cu2++4H2O+2NO↑;由于NO气体易与氧气反应,不溶于水也不与水反应,可以用排水法收集NO气体;正确答案:3Cu+8H++2NO3- = 3Cu2++4H2O+2NO↑; 排水法。
③Ⅲ装置气密性检查的方法:将导气管插入水槽的水中,给烧瓶加热,如果导气管口有气泡冒出,冷却后导气管内有一段液柱上升,说明气密性良好;否则漏气;正确答案:将导气管插入水槽的水中,给烧瓶加热,如果导气管口有气泡冒出,冷却后导气管内有一段液柱上升,说明气密性良好;否则漏气。
(2)①常温下,高锰酸钾和浓盐酸可以发生反应生成Cl2和可溶性MnCl2,反应的化学方程式为:2KMnO4+16HCl(浓)= 2MnCl2+2KCl+5Cl2↑+8H2O,其中Mn元素化合价由+7价降到+2价,被还原,高锰酸钾为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,所以氯气为氧化产物;反应的离子方程式为:2MnO4-+10Cl-+16H+= 2Mn2++5Cl2↑+8H2O;正确答案:KMnO4; Cl2 ;2MnO4-+10Cl-+16H+= 2Mn2++5Cl2↑+8H2O。
②利用高锰酸钾和浓盐酸反应制备出的氯气中含有杂质气体氯化氢和水蒸气,因此混合气体要依次通过饱和食盐水(装置C)除去氯化氢,再通过氯化钙(装置B)吸收水蒸气,得到纯净的氯气装置H中,氯气先进入装有干燥红色布条的装置(E),然后再进入装有湿润红色布条的装置(G),加以验证起漂白作用的是次氯酸而不是氯气;最后尾气进入装置f中进行吸收;所以正确的连接顺序为:a→d→e→b,c(c,b) →k,l→g,h→i,j →f;正确答案:→b,c(c,b) →k,l→g,h→i,j 。
③氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2 + 2OH- = Cl-+ ClO-+ H2O;正确答案:Cl2 + 2OH- = Cl-+ ClO-+ H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是:
A. 摩尔是物质的量的单位,毎摩尔物质含有6.02×1023个分子
B. 1 mol氧的质量为16 g
C. 0.5 mol氦气约含有6.02×1023个电子
D. 2H既可表示2个氢原子又可表示2 mol氢分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成下列各题:
(1)在标准状况下,气体A的密度为3.17gL﹣1 , 则气体A的摩尔质量为;
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入某种物质M的饱和溶液,继续煮沸可制得一种红褐色胶体. ①物质M的名称为 .
②下列关于M的水溶液和上述操作所得胶体的叙述,正确的是
A.M的水溶液是电中性的,所得胶体是带电的
B.二者分散质的粒子都不能透过半透膜
C.二者可用丁达尔效应区别
D.向两者中逐滴滴加盐酸溶液均无明显现象
若胶体中含有杂质M则可用法提纯此分散系.
(3)同温同压下,同体积的CO2和CO,它们的分子数之比为 , 物质的量之比为 , 密度之比为 .
(4)V L硫酸铝溶液中含有m gAl3+ , 则溶液中SO42﹣的物质的量浓度是molL﹣1 , 硫酸铝的物质的量浓度是molL﹣1
(5)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g.此混合物中CO和CO2的物质的量比是 , CO的体积分数是 , C和O的原子个数比是 .
(6)3.01×1023个OH﹣的质量为 , 含有电子的物质的量为 , 和克Na+含有的离子数相同.
(7)欲除去粗盐中的Ca2+ , Mg2+ , SO42﹣等杂志,溶解后可依次加入、、 , 过滤出沉淀后再加入 , 蒸发结晶即可.(填写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.乙烯的结构简式为C2H4
B.质子数为53,中子数为78的碘原子:53131I
C.S2﹣的结构示意图: ![]()
D.NH4Cl的电子式为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学键与化学反应中的物质变化密切相关。
现有下列七种物质 : ①氯水 ②氦气 ③ 过氧化钠 ④ 硫酸 ⑤碘 ⑥硫酸氢钠 ⑦氯化钠 回答下列问题:
(1)不存在化学键的是______(填序号,下同),属于共价化合物的是_______________。
(2)碘的升华属于__________变化(填“物理”、“化学”),化学键_________(填“是”、“未”)发生变化。过氧化钠的电子式为_______________________。
(3)将NaHSO4溶于水,电离方程式为_____________,NaHSO4在熔融状态下存在的离子为________。
(4)其他平衡类同化学平衡,已知氯水中存在下列平衡 Cl2+H2O ![]() HCl +HClO, HClO
HCl +HClO, HClO ![]() H++ClO-。则氯水中含有的分子有__________________________。
H++ClO-。则氯水中含有的分子有__________________________。
(5)设计实验证明氯化钠为离子化合物___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3 , 还含有硅、铝等杂质.制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
(2)滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质.
(3)步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示).
(4)有关物质的溶解度如图所示.
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 .
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 向澄清石灰水中通入足量二氧化碳:2OH+CO2===![]() +H2O
+H2O
B. 氧化钠投入水中发生反应:![]() +H2O===2OH
+H2O===2OH
C. 醋酸溶液滴入到NaOH溶液中:CH3COOH+OH===CH3COO+H2O
D. 铁和稀盐酸反应制氢气:2Fe+6H+===2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各装置图的叙述中,错误的是( ) 
A.实验室用装置①蒸馏石油
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是电解精炼铜,b极为粗铜,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表四种短周期元素,
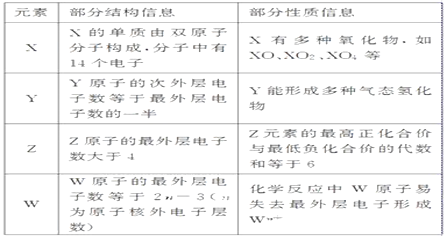
有关它们的部分结构信息及性质信息如表所示。请按要求回答下列问题:
(1)Z在元素周期表中的位置是________________。
(2)X、Y的气态氢化物的稳定性由强到弱的顺序是______________(用化学式表示)。
(3)X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是____________________(用化学式表示)。
(4)实验室用X的气态氢化物的水溶液制取W的氢氧化物的方法是______________________(用离子方程式表示)。
(5)写出Z的单质与二氧化硫的混合气体通入水中所发生反应的离子方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com