
����Ŀ������ƽ����ϵmA(g)��nB(g) ![]() pC(g)��qD(g)����H��0�����н����д������
pC(g)��qD(g)����H��0�������������
A. ���¶Ȳ��䣬�������������С��ԭ����һ�룬��ʱA��Ũ��Ϊԭ����2.1������m��n��p��q
B. ��ƽ��ʱ��A��B��ת������ȣ�˵����Ӧ��ʼʱ��A��B�����ʵ���֮��Ϊm��n
C. ��m��n��p��q����������a mol�����ƽ����ϵ���ټ���a mol��B���ﵽ��ƽ��ʱ������������ʵ�������2a
D. ���¶Ȳ���ʱѹǿ����ԭ����2�����ﵽ��ƽ��ʱ�������һ����ԭ����![]() ҪС
ҪС
���𰸡�D
��������
����Ũ�ȡ�ѹǿ���¶ȶԻ�ѧƽ���Ӱ��������
A����������С��ԭ��һ�루����ѹ����˲����A��Ũ��Ϊԭ����2������ƽ��ʱA��Ũ��Ϊԭ����2.1������ƽ�����ơ���ƽ���ƶ�ԭ������m��n ��p��q��A����ȷ��
B�����ʼʱA��B�����ʵ����ֱ�Ϊx��y��ƽ��ʱA��B��ת���ʷֱ�Ϊ����������(x��)��(y��)��m��n����������ʱ��x��y��m��n��B����ȷ��
C�m��n��p��qʱ����Ӧ����������������䡣������a mol�����ƽ����ϵ���ټ���a mol B�������Ƿ�ﵽ��ƽ�⣬���������ʵ���������2a mol��C����ȷ��
D�����С�������ʹ��ƽ��ѹǿ��ԭ����2��������ƽ�����С��ԭ����![]() ����ͨ���뷴Ӧ�ص�����ʹѹǿ���ԭ����2������������Բ��䡣D�����
����ͨ���뷴Ӧ�ص�����ʹѹǿ���ԭ����2������������Բ��䡣D�����
����ѡD��


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1��д���������������ƣ�
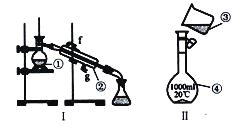
��__________________����__________________����__________________��
��2�������������У�ʹ��ʱ�������Ƿ�©ˮ����_______________������š�
��3����������250 mL0.2mol/LNaCl��Һ��װ��II��ijͬѧת����Һ��ʾ��ͼ��ͼ������������_____________��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�������Cl2ֱ�ӷ�Ӧ�Ƶõ���
A.CuCl2B.FeCl2C.Ca(ClO)2D.NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����300 Kʱ��A(g)��B(g) ![]() 2C(g)��D(s)�Ļ�ѧƽ�ⳣ��K��4���ڸ��¶��£���1 L�����м���1 mol A��1 mol B������Ӧ����������������Ϊ�÷�Ӧ�ﵽƽ��״̬�ı�־����
2C(g)��D(s)�Ļ�ѧƽ�ⳣ��K��4���ڸ��¶��£���1 L�����м���1 mol A��1 mol B������Ӧ����������������Ϊ�÷�Ӧ�ﵽƽ��״̬�ı�־����
��C������������C������������� �ڵ�λʱ��������a mol A��ͬʱ����2a mol C ��A��B��C��Ũ�Ȳ��ٱ仯 ����C�����ʵ������ٱ仯 �ݻ���������ѹǿ���ٱ仯 ���������ܶȲ��ٱ仯 ��A��B��C�ķ�����֮��Ϊ1��1��2
A. �ڢ� B. �ܢ� C. �ڢ� D. �ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ�㷺Ӧ�����л��ϳɡ�ʯ�͡���֬��Ⱦ�ϵȹ�ҵ����ij��ͭ���(��Cu2S��CuS��FeS��)Ϊԭ����ȡCuCl�Ĺ�������������
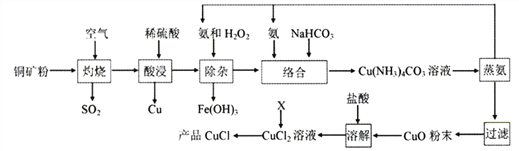
��֪����CuS��Cu2S��FeS���չ������ΪCu2O��FeO��
��Ksp(CuCl)=2��10-7��2Cu+=Cu+Cu2+��ƽ�ⳣ��K1=1��106
�ش�����������
��1����������ʱ������ԭ��Ԫ����____________(��Ԫ�ط���)��
��2�������������H2SO4���õ������98%H2SO4��ˮ��϶��ɡ�ʵ�������Ƹ�������Һ����IJ�������������������ͷ�ι���������_______���������ʱ����˹����ԭ����__________________��
��3�������������ܷ�Ӧ����ʽ��_____________________��
��4�����������Ӧ�е�NH3��NaHCO3���۱�ֵ��____________________��
��5���������������ڼ�ѹ�����½��е�ԭ����________________��
��6��X���Գ�����������еIJ�������X��SO2ʱ��ͨ��CuCl2��Һ�з�Ӧ�����ӷ���ʽ��________________����X��Cuʱ����ӦCu+Cu2++2Cl-=2CuCl��ƽ�ⳣ��K2=_________��
��7����ͭΪ�������NaCl��ҺҲ�ɵõ�CuCl��д�������缫��Ӧʽ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������F��һ���л��������м��壬��A�Ʊ�F��һ�ֺϳ�·������:

��֪:![]()
�ش���������:
(1)A�Ľṹ��ʽΪ________��C�Ļ�ѧ������______��
(2)�١��۵ķ�Ӧ���ͷֱ���______��_______��
(3)�ڵķ�Ӧ������_______���л���X�Ľṹ��ʽΪ____________��
(4)��Ӧ�ݵĻ�ѧ����ʽΪ___________________��
(5)���㻯����H��D��ͬ���칹�壬��������������ͬ���칹�干��____�֣�
a.�ܷ���������Ӧ b.���С�C��CH���� c.�ޡ�C��C��O���ṹ
д�����к˴Ź������������Ϊ1:2:2:1��һ���л���Ľṹ��ʽ_______��
(6)д����1-��Ȳ����ȲΪԭ����ȡ������ �ĺϳ�����(�����Լ���ѡ)_____��
�ĺϳ�����(�����Լ���ѡ)_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����100mL0.100molL��1Na2CO3��Һ�ļ����ؼ�ʵ�鲽��Ͳ�������ͼ�ش��������⣺

��1��������ƿ����һ�����ʵ���Ũ�ȵ���Һ��������ƿ������_____��
������� ��ƿ����©ˮ�� ���������Ƶ���Һ��ϴ���� �������������Ҫ���
��2������Na2CO310H2O��������Һ����Ҫ��������_____�ˡ�������ȡ�ľ����Ѿ���һ����ʧȥ�˽ᾧˮ���������Ƶ���ҺŨ��ƫ_____�������/С����
��3��д��������Һ������Ҫ�õ��IJ������������ƣ��ձ���_____��
��4������Bͨ����Ϊת�ƣ�����Aͨ����Ϊ_____������D��Ϊ_____����û�в���D�������Ƶ�Ũ��ƫ_____�������/С������
��5��������ʵ�鲽��A��F��ʵ������Ⱥ��������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ(HCHO)����ɫ���壬������ˮ��������Ĵ���ζ�������ۡ��ǵ��д̼����á�40%��ȩ��Һ�е�Ϊ96�棬�ӷ�����ȩ�ڼ�����Һ�о��м�ǿ�Ļ�ԭ�ԡ�Ϊ̽��������ȩ������Cu(OH)2��Ӧ�IJ���ɷ֣����������о���
��1������ͼװ���н���ʵ�飬��a�м���0.5mol��L-1CuSO4��Һ50mL��5 mol��L-1 NaOH��Һ100mL�����ټ���40%�ļ�ȩ��Һ40mL����������a����65��ʱ����20���Ӻ���ȴ�����¡���Ӧ�����й۲쵽����ɫ�������ɣ�����ɺ�ɫ���������������

������b��������____________��
������c������Ϊ____________��
����˵����ȩ���л�ԭ�Ե�ʵ��������____________��
��2���������Ϸ�����������Ǹ���Ӧ�����ġ�Ϊȷ����������к�H2����CO����װ��A������ͼ��ʾ��װ�����Ӻ����ʵ�顣

���������ӵĺ���˳��Ϊ��A��B��_____��_____��_____��_____��G��________
��װ��B��������_______________��
��ȷ����������к�H2������CO��������_________________________��
��3����֪��![]() ��֤��a�м�ȩ��̼Ԫ��δ��������+4�۵�ʵ�鷽��Ϊ��ȡ����a�з�Ӧ�����Һ��____________________����˵����ȩ��̼Ԫ��δ��������+4�ۡ�
��֤��a�м�ȩ��̼Ԫ��δ��������+4�۵�ʵ�鷽��Ϊ��ȡ����a�з�Ӧ�����Һ��____________________����˵����ȩ��̼Ԫ��δ��������+4�ۡ�
��4��Ϊ�о���ɫ����������ɣ���������ʵ��(����ÿ������ַ�Ӧ)��

��֪����.Cu2O ![]() [Cu(NH3)4]+(��ɫ)
[Cu(NH3)4]+(��ɫ) ![]() [Cu(NH3)4]2+(��ɫ)
[Cu(NH3)4]2+(��ɫ)
��.2Cu+8NH3��H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
ͨ������ʵ�飬���Եó���ɫ���������Ҫ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���ձ���ʢ�е������ˮ��ú�ͣ��ֽ�һС������Ƽ����ձ��У����ƶ��ܹ۲쵽��ʵ������Ӧ�ǣ� ��

A. ��������ú�Ͳ���
B. �ƾ�ֹ����Һ��֮��
C. �Ƴ���ˮ����
D. ������Һ����渽����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com