
����Ŀ�����±���Ԫ�����ڱ���һ���֣����ݱ����г���10��Ԫ�أ��ش��������⡣

��1��O��S�У�ԭ�Ӱ뾶�ϴ����________��(��Ԫ�ط��Ż�ѧ������ͬ)
��2��CH4��NH3�У����ȶ��Խ�ǿ����________��
��3��������ˮ��Ư�����ã�����Ϊ���к���________��
��4��Ԫ������������Ӧˮ�����У���������������________________��
��5���ϱ�Ԫ���У��������������Ӧˮ����ļ�����ǿ����Һ���Լ�ƿ�Dz����ò���������д���÷�Ӧ�����ӷ���ʽ_______________��
�����в���Ԫ�ص�������ԭ�ӣ�����ӣ��ṹ���±���
Ԫ�ر�� | Ԫ��������ԭ�ӣ�����ӣ��ṹ |
T | �����������Ǵ�����������3�� |
X | �����µ���Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷ� |
Y | M���K����1������ |
Z | ��3����Ԫ�صļ������а뾶��С |
��1��Ԫ��T��Ԫ�����ڱ��е�λ����________________��
��2��Ԫ��Y��Ԫ��Z��ȣ������Խ�ǿ����______����Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ����______������ţ���
a��Y���ʵ��۵��Z���ʵ�
b��Y�Ļ��ϼ۱�Z��
c��Y������ˮ��Ӧ��Z���ʾ���
d��Y����������ˮ����ļ��Ա�Zǿ
��3����������Ԫ������2��Ԫ�����γ�һ�ֵ���ɫ�Ĺ��壬�û�����ĵ���ʽ��________________��������ѧ����������________________��
���𰸡� S NH3 HClO Al(OH)3 SiO2+2OH��= SiO32��+H2O ��2����VIA�� Na c d ![]() ���Ӽ������ۼ�����Ǽ��Լ���
���Ӽ������ۼ�����Ǽ��Լ���
������������Ԫ�������ڱ��е�λ�ã����Ԫ�ؼ��仯��������ʺ�Ԫ�������ɽ��
��Tԭ�ӵ������������Ǵ�����������3�����������������ܳ���8������T����Ԫ�أ�X�γɵĵ��ʳ�����Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷԣ��ǵ�������X�ǵ�Ԫ�أ�Yԭ�ӵ�M���K����1�����ӣ���Y����Ԫ�أ�Z�ǵ�3����Ԫ�صļ������а뾶��С�ģ�����Z����Ԫ�أ��ݴ˽��
��1��O��Sλ��ͬһ���壬���ϵ���ԭ�Ӱ뾶��������ԭ�Ӱ뾶�ϴ����S��
��2���ǽ�����N��C���ǽ�����Խǿ�����⻯����ȶ���Խǿ����CH4��NH3�У����ȶ��Խ�ǿ����NH3��
��3��������ˮ��Ư�����ã�����Ϊ���к���HClO�����������ǿ�����Զ���Ư�����ã�
��4��Ԫ������������Ӧˮ�����У���������������Al(OH)3��
��5��������Խǿ������������Ӧˮ����ļ���Խǿ������Ԫ��������������Ӧˮ����ļ�����ǿ����NaOH����ǿ�����������跴Ӧ������Ժ�ǿ�Ĺ����ƣ����ʢ������������Һ���Լ�ƿ�����ò���������Ӧ�ķ���ʽΪSiO2+2OH��=SiO32��+H2O��
�������Ϸ�����֪T��O��X��N��Y��Na��Z��Al����
��1����Ԫ����Ԫ�����ڱ��е�λ���ǵڶ�����VIA�塣
��2��ͬ�����������ҽ�������������Ԫ��Y��Ԫ��Z��ȣ������Խ�ǿ����Na��
a��������ǿ���뵥�ʵ��۵�ߵ�û�й�ϵ��a����
b��������ǿ����Ԫ�صĻ��ϼ۸ߵ�û�й�ϵ��b����
c��������Խǿ����ˮ���ᷴӦԽ���ң���Y������ˮ��Ӧ��Z���ʾ��ҿ���˵����������ǿ������c��ȷ��
d��������Խǿ������������Ӧˮ����ļ���Խǿ��Y����������ˮ����ļ��Ա�Zǿ����˵����������ǿ������d��ȷ��
��ѡcd��
��3����������Ԫ������2��Ԫ�����γ�һ�ֵ���ɫ�Ĺ��壬���������γɵĹ������ƣ��û�����ĵ���ʽ��![]() ��������ѧ�������������Ӽ������ۼ�����Ǽ��Լ�����
��������ѧ�������������Ӽ������ۼ�����Ǽ��Լ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����CO����ȼ�ϼ״���һ���¶Ⱥ��ݻ������·�����Ӧ��CO(g)+2H2(g)![]() CH3OH(g)��ͼ1��ʾ��Ӧ�е������仯��ͼ2��ʾһ���¶��£������Ϊ1L���ܱ������м���2mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯��
CH3OH(g)��ͼ1��ʾ��Ӧ�е������仯��ͼ2��ʾһ���¶��£������Ϊ1L���ܱ������м���2mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯��
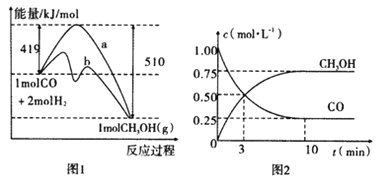
��ش��������⣺
��1���ڡ�ͼ1���У�����_________(�a����b��)��ʾʹ���˴�����û��ʹ�ô���ʱ���ڸ��¶Ⱥ�ѹǿ�����·�ӦCO(g)+2H2(g)![]() CH3OH(g)����H=_____________��
CH3OH(g)����H=_____________��
��2������˵����ȷ����__________��
A����ʼ�����CO�����ʵ���Ϊ1mol
B������CO��Ũ�ȣ�H2��ת���ʻ�����
C��������ѹǿ�㶨ʱ����Ӧ�ﵽƽ��״̬
��3���ӷ�Ӧ��ʼ������ƽ�⣬v(CO)=____________���ﵽƽ��ʱ��c(H2)=_________�����¶���CO(g)+2H2(g) ![]() CH3OH(g)�Ļ�ѧƽ�ⳣ��Ϊ______________���ﵽƽ��������������������䣬���������ѹ��Ϊ0.5L����ƽ��___________�ƶ� (�������������)��4����֪CH3OH(g)��3/2O2(g)��CO2(g)��2H2O(g)����H����193kJ/mol����֪H2O(l)= H2O(g)��H����44 kJ/mol����д��32g��CH3OH(g)��ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ___________________________________________________��
CH3OH(g)�Ļ�ѧƽ�ⳣ��Ϊ______________���ﵽƽ��������������������䣬���������ѹ��Ϊ0.5L����ƽ��___________�ƶ� (�������������)��4����֪CH3OH(g)��3/2O2(g)��CO2(g)��2H2O(g)����H����193kJ/mol����֪H2O(l)= H2O(g)��H����44 kJ/mol����д��32g��CH3OH(g)��ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ___________________________________________________��
(5)��֪����PCl3�ķ��ӽṹ��ͼ��ʾ�����ṩ���»�ѧ���ļ���(kJ��mol��1)��P��P��198��Cl��Cl ��243��P��Cl��331��
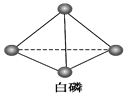
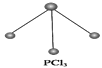
��ӦP4(���ף�s)��6Cl2(g)![]() 4PCl3(s)�ķ�Ӧ�Ȧ�H��____________________��
4PCl3(s)�ķ�Ӧ�Ȧ�H��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʾ���ʱ仯�Ļ�ѧ�����У���ȷ���ǣ� ��
A. ���������绯ѧ��ʴ��������Ӧʽ��Fe��2e����Fe2+
B. HS����ˮ�ⷽ��ʽ��HS��+H2O![]() S2��+H3O+
S2��+H3O+
C. CO32����ˮ�ⷽ��ʽ��CO32��+H2O![]() HCO3��+OH��
HCO3��+OH��
D. AlCl3��Һ��Na2CO3��Һ��ϣ�2Al3++3CO32����Al2��CO3��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. �辧���У���NA��Si����2 NA��Si��Si��
B. ���³�ѹ�£������ʵ���Ũ�ȵ�Na2CO3��Na2S��Һ��Na+��Ŀ���
C. ���Ե缫���ʳ��ˮ������·��ͨ��2 NA�����ӵĵ���ʱ����������������22.4 L
D. ��״���£�2 mol Na2O2��44.8 L SO2��ȫ��Ӧ��ת�Ƶĵ�����ĿΪ2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС�����ʵ��̽��NO��ͭ�۵ķ�Ӧ������NO��ʵ��װ����ͼ��ʾ���г�װ���ԣ���ʵ�鿪ʼǰ����װ����ͨ��һ��ʱ���N2���ž�װ���ڵĿ�����
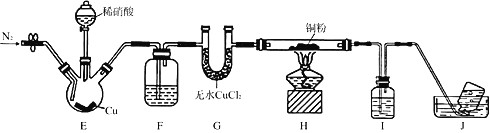
��֪������Һ�У�FeSO4��NO![]() [Fe(NO)]SO4����ɫ�����÷�Ӧ�����ڼ���NO�����жԸ�ʵ����������������
[Fe(NO)]SO4����ɫ�����÷�Ӧ�����ڼ���NO�����жԸ�ʵ����������������
A. װ��F��I�е��Լ�����Ϊˮ������������Һ
B. װ��J�ռ��������в���NO
C. ʵ���������Ϩ��ƾ��ƣ��ٹرշ�Һ©���Ļ���
D. ���۲쵽װ��H�к�ɫ��ĩ���ɫ����NO��Cu�����˷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Na2O��Na2O2��������ȷ���ǣ� ��
A.Na2O��Na2O2������ˮ��Ӧ�����������ƣ����Զ��Ǽ���������
B.Na2O��Na2O2�ֱ���CO2��Ӧ�IJ�����ȫ��ͬ
C.�����£����ڿ����з�Ӧ���ɹ�������
D.�ں�������У�Na2O2����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NaHSO4��ˮ�еĵ��뷽��ʽΪNaHSO4=Na++H++SO42-��ij�¶��£���pH=6������ˮ�м���NaHSO4���壬�����¶Ȳ��䣬�����Һ��pHΪ2�����ڸ���Һ��������������ȷ����
A. ˮ���������c(H+)=1��10-10mo1��L-1
B. ��ʱˮ�����ӻ�KW=1��10-4
C. c(H+)=2[c(OH-)+c(SO42-)]
D. ���¶��¼�������pH=12��NaOH��Һ��ʹ��Ӧ�����Һǡ�ó�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��Na2SO3��Һ���������ڰ�ɫ��ΰ��a��b��c��d�ĸ������е���Na2SO3��Һ���ٷֱ�μ���ͼ��ʾ���Լ���

���й���ʵ������Ľ��ͻ������ȷ����
ѡ�� | ʵ������ | ���ͻ���� |
A | a������������ | Na2SO3��H2O2һ����������Ӧ |
B | b�м�ϡH2SO4��Ų�������ɫ���� | SO32��S2��������һ�����ܴ������� |
C | c�м�BaCl2��Һ�������ɫ�����Һ�ɫ��ȥ | Ba2++ SO32 == BaSO3����ʹSO32ˮ��ƽ�������ƶ�����ɫ��ȥ |
D | d�в�����ɫ���� | ԭNa2SO3��Һ�к���SO42 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤����������ֵ������˵����ȷ���ǣ� ��
A.��״���£�22.4LCCl4����NA������
B.0.1mol/L��HNO3����0.1NA��H+
C.���³�ѹ�£�8gO2����4NA������
D.1molNa����ȫ��������Na+ �� ʧȥ2NA������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com