
 H++ClO-,
H++ClO-, H++ClO-;
H++ClO-; Al3++3OH-,
Al3++3OH-, Al3++3OH-;
Al3++3OH-; H++HCO3-,HCO3-
H++HCO3-,HCO3- H++CO32-,
H++CO32-, H++HCO3-,HCO3-
H++HCO3-,HCO3- H++CO32-.
H++CO32-.


科目:高中化学 来源: 题型:
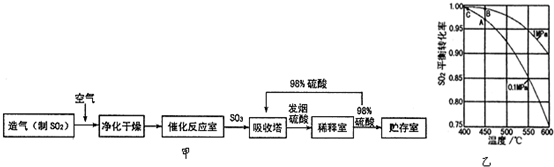
| Q1 |
| 2 |
| Q1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
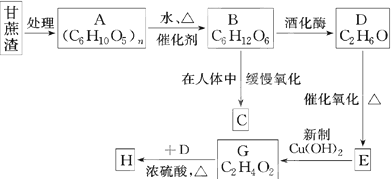
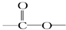 链状结构的同分异构体最多有
链状结构的同分异构体最多有查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
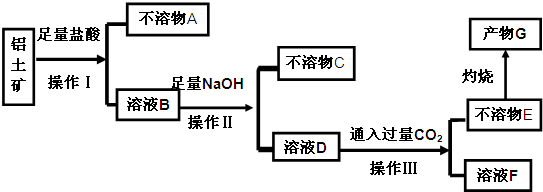
查看答案和解析>>
科目:高中化学 来源: 题型:
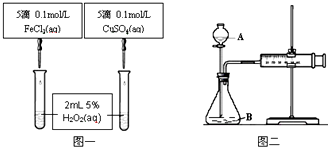
查看答案和解析>>
科目:高中化学 来源: 题型:
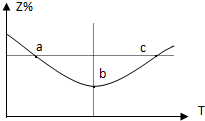 在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )
在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )| A、升高温度,平衡常数减小 |
| B、Z在a、c两点的反应速率相等 |
| C、b点时,Z的转化率最小 |
| D、平衡时充入惰性气体时,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com