
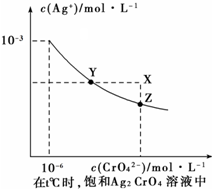
 已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )
已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )| A、t℃时,Y点对应的Ksp(Ag2CrO4)为1×10-9 |
| B、t℃时,Ag2CrO4的溶解度(mol/L)小于AgCl |
| C、t℃时,若使溶液由Z点到X点,可采取在饱和Ag2CrO4溶液中加入适量AgNO3固体的办法实现 |
| D、t℃时,利用沉淀滴定法,用标准AgNO3溶液滴定KCl溶液的浓度时,可滴入几滴K2CrO4溶液做指示剂 |
| Ksp |
| 2×10-10 |
| 3 |
| ||
| 3 |
| ||
| |||
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质溶液里加(NH4)2SO4溶液可提纯蛋白质 |
| B、在豆浆中加入少量石膏能使豆浆凝结为豆腐 |
| C、温度越高,酶对某些化学反应的催化效率越高 |
| D、鉴别某纺织物成分是蛋白丝还是人造丝,可采用灼烧闻气味的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=2c( HS-)+2c(S2-)+2c(H2S) |
| B、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C、c(Na+)>c(S2-)>c(OH-)>c(HS-) |
| D、c(OH-)=c(HS-)+c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
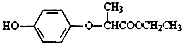 是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )
是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )| A、该有机物的分子式为C11H14O4 |
| B、该有机物具有7种不同化学环境的氢原子 |
| C、该有机物能与NaOH溶液反应,生成3种有机物 |
| D、1mol该有机物完全燃烧,将消耗12.5molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、锂离子电池与传统铅蓄电池相比,具有高比能量(比能量指的是单位重量或单位体积的能量)的特点 |
| B、废旧锂离子电池先进行“放电处理”让Li+进入石墨(C6)中而利于回收 |
| C、放电时,正极锂的化合价未发生改变 |
| D、充电时电池正极上发生的反应为:LiCoO2-x e-═Li1-x CoO2+xLi+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com