
| A、c(Na+)=2c( HS-)+2c(S2-)+2c(H2S) |
| B、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C、c(Na+)>c(S2-)>c(OH-)>c(HS-) |
| D、c(OH-)=c(HS-)+c(H+)+c(H2S) |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4NO3 溶于水吸热,但仍能自发进行,是因为该过程熵增加 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
| C、不借助于外力而自发进行的过程,其体系的能量一定是由高能状态转变为低能状态 |
| D、要判断反应进行的方向,必须综合考虑体系的焓变和熵变. |
查看答案和解析>>
科目:高中化学 来源: 题型:
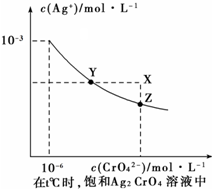 已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )
已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )| A、t℃时,Y点对应的Ksp(Ag2CrO4)为1×10-9 |
| B、t℃时,Ag2CrO4的溶解度(mol/L)小于AgCl |
| C、t℃时,若使溶液由Z点到X点,可采取在饱和Ag2CrO4溶液中加入适量AgNO3固体的办法实现 |
| D、t℃时,利用沉淀滴定法,用标准AgNO3溶液滴定KCl溶液的浓度时,可滴入几滴K2CrO4溶液做指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食醋和料酒的主要成分都是有机酸 |
| B、食盐和味精的成分中都含有钠离子 |
| C、蔗糖和小苏打都是可溶于水的电解质 |
| D、食用油和人造奶油都不能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+6 | B、+3 | C、+2 | D、0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述三个反应都有单质生成,所以都是置换反应 |
| B、反应①和反应③中均生成Br2,溴元素发生的变化相同 |
| C、反应②中被氧化与被还原物质的物质的量之比为6:1 |
| D、③中lmol还原剂反应则氧化剂得到电子的物质的量为10mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com