
|
|


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度能加快生成尿素的速率 |
| B、增大压强能使反应有利于向生物方向移动 |
| C、氨碳比越大越有利于尿素的生成 |
| D、若氨能与反应生成的水结合生成一水合氨,则能促使平衡向生成尿素方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4NO3 溶于水吸热,但仍能自发进行,是因为该过程熵增加 |
| B、同一种物质气态时熵值最大,液态时次之,而固态时熵值最小 |
| C、不借助于外力而自发进行的过程,其体系的能量一定是由高能状态转变为低能状态 |
| D、要判断反应进行的方向,必须综合考虑体系的焓变和熵变. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
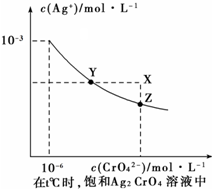 已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )
已知:t℃时,Ag2CrO4(红色固体)在水中的沉淀溶解平衡曲线如图所示; t℃时AgCl的Ksp=2×10-10.下列说法正确的是( )| A、t℃时,Y点对应的Ksp(Ag2CrO4)为1×10-9 |
| B、t℃时,Ag2CrO4的溶解度(mol/L)小于AgCl |
| C、t℃时,若使溶液由Z点到X点,可采取在饱和Ag2CrO4溶液中加入适量AgNO3固体的办法实现 |
| D、t℃时,利用沉淀滴定法,用标准AgNO3溶液滴定KCl溶液的浓度时,可滴入几滴K2CrO4溶液做指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、航天飞机上的隔热陶瓷瓦属于复合材料 |
| B、水泥、陶瓷均为硅酸盐产品 |
| C、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 |
| D、化学反应能够制造出新的物质,同时也能制造出新的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2+ NaOH=NaHCO3 | ||||
B、Fe2O3+3H2
| ||||
| C、Cu+2 FeCl3=2FeCl2+Cu | ||||
| D、2F2+2H2O=4HF+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com